微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2?只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:______(填序号).
A.盐酸 ?B.浓硫酸 ? C.稀硫酸 ? D.醋酸.
(2)该反应中发生还原反应的过程是:______→______.
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:______
(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为______mol.
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为______.
(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是______.
参考答案:(1)这是MnO4-酸性环境下氧化H2O2的反应,
A、盐酸也会被MnO4-氧化,故A错误;
B、浓硫酸没有必要,这里主要利用硫酸的酸性就可以了,不需要浓硫酸,浓硫酸是利用它的吸水性、强氧化性等情况才用的,故B错误;
C、稀硫酸可以提供酸性环境并且不易被高锰酸根氧化,故C正确;
D、醋酸酸性弱,还可能被MnO4-氧化,故D错误.
故选C.
(2)该反应过程中,MnO4-的Mn元素化合价降低,在反应中被还原生成Mn2+,发生还原反应,
故答案为:MnO4-;Mn2+;
(3)该反应过程中,高锰酸根的氧化性和双氧水的还原性导致二者间发生氧化还原反应,
即2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,在该反应中,化合价升高值=化合价降低值=转移电子数=10,
电子转移情况如下:
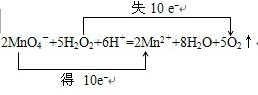
,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,

;
(4)上述反应中生成5mol氧气转移电子10mol,当反应中有6.72L(标准状况)即0.3mol氧气生成时,则转移的电子为0.6mol,故答案为:0.6;
(5)反应KCN+H2O2+H2O═A+NH3↑中,根据原子守恒可知生成物A的化学式为KHCO3,故答案为:KHCO3;?
(6)H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性,所以H2O2被称为绿色氧化剂,
故答案为:H2O2是氧化剂,其产物是H2O,H2O没有毒性及污染性.
本题解析:
本题难度:一般
2、填空题 在反应S+2KNO3+3C=K2S+N2↑+3CO2↑中,______元素被氧化,______元素被还原;______?元素的原子得到电子,______?元素的原子失去电子;______是氧化剂,______是还原剂;______是氧化产物,______是还原产物.
参考答案:S+2KNO3+3C=K2S+N2↑+3CO2↑中,S元素的化合价0→-2价,N元素的化合价由+5价→0价,C元素的化合价由0价→+4价,所以被氧化的元素是C,被还原的元素是S、N;
S、N元素的原子得电子化合价降低,C元素的原子失电子化合价升高;
得电子化合价降低的反应物是S、KNO3,作氧化剂,失电子化合价升高的反应物是C,作还原剂;
氧化产物是CO2,还原产物是K2S、N2,
故答案为:C;S、N;S、N;C;S、KNO3;C;CO2;K2S、N2.
本题解析:
本题难度:一般
3、选择题 Zn粉与碘晶体混合后看不到明显变化,但当滴入少量水后,则立即剧烈反应,那么在此反应中水的作用是( )
A.氧化剂
B.还原剂
C.还原产物
D.催化剂
参考答案:Zn粉与碘晶体混合后看不到明显变化,反应较缓慢,而滴入少量水后,则立即剧烈反应,反应速率加快,
显然水的加入,反应速率加快,
则水在该反应中作催化剂,降低反应所需的活化能,
故选D.
本题解析:
本题难度:简单
4、简答题 钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等.某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
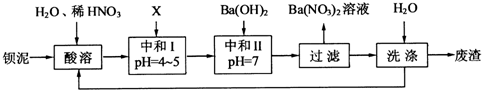
(1)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为______.
(2)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是______、______.
(3)该厂结合本厂实际,选用的X为______(填化学式);中和Ⅰ使溶液中______(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略).
(4)上述流程中洗涤的目的是______.
参考答案:(1)Ba(FeO2)2中Fe元素是+3价,故Ba(FeO2)2与硝酸不发生氧化还原反应,其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(2)酸溶时控制反应温度不超过70℃,是为了防止温度过高,反应速率太快;不使用浓硝酸,是因为浓HNO3不稳定,易分解,易挥发,故答案为:防止反应速率过快 浓HNO3易挥发、分解(凡合理答案均可);
(3)加入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3;中和后溶液中H+浓度减小,pH在4~5时,Fe3+也完全沉淀,故Fe3+浓度也减小,故答案为:BaCO3;Fe3+、H+;
(4)因为钡盐是重金属盐,有毒,故洗涤的目的是减少废渣中可溶性钡盐对环境的污染,故答案为:减少废渣中可溶性钡盐对环境的污染(凡合理答案均可).
本题解析:
本题难度:一般
5、选择题 现行的道路交通安全法规定,醉酒后驾驶机动车的,处15日以下拘留和暂扣 3个月以上6个月以下机动车驾驶证,并处500元以上2000元以下罚款.用重铬酸钾检验酒精的反应原理如下:2K2Cr2O7+3CH3CH2OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
关于该反应的说法正确的是( )
A.该反应不是氧化还原反应
B.K2Cr2O7是氧化剂
C.K2Cr2O7是还原剂
D.K2Cr2O7表现还原性
参考答案:依据氧化还原反应中“升失氧,降得还”分析反应中的元素化合价变化分析得到,反应中2K2Cr2O7+3CH3CH2OH+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O;铬元素化合价+6价降低到+3价;得到电子做氧化剂发生还原反应;碳元素化合价升高从-2价升高为0价;做还原剂被氧化发生氧化反应;
A、反应前后有元素化合价的变化,属于氧化还原反应,故A错误;
B、K2Cr2O7铬元素化合价+6价降低到+3价;得到电子做氧化剂发生还原反应;是氧化剂,故B正确;
C、K2Cr2O7铬元素化合价+6价降低到+3价;得到电子做氧化剂发生还原反应;是氧化剂,故C错误;
D、K2Cr2O7铬元素化合价+6价降低到+3价;得到电子做氧化剂发生还原反应;是氧化剂,表现氧化性,故D错误;
故选B.
本题解析:
本题难度:简单