微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)硝酸是重要的工业原料。
①可用铝制容器存放浓硝酸的理由是?;
②某硝酸厂处理尾气NO2的方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g) + O2(g) = 2H2O(g)?△H=-483 kJ·moL-1
N2(g) + 2O2(g) = 2NO2(g)?△H=+68 kJ·moL-1
则H2还原NO2生成水蒸气的热化学方程式是:
?。
(2)某研究小组以CaCl2和H2为原料制备+1价Ca的化合物,产物中只有甲和乙两种化合物。研究发现:化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%;化合物乙的水溶液显酸性。请回答下列问题:
①乙的化学式为?,甲与水反应可得H2,其化学方程式是:?;
②写出由CaCl2通过化合反应制备CaCl的化学方程式:?。
参考答案:(1)①常温下,浓硝酸可使铝表面形成致密的氧化膜而钝化(2分)
②4H2(g) + 2NO2(g)=N2(g) + 4H2O(g)?△H=-1034 kJ·moL-1(3分)
(2)①HCl(1分)? 2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑(3分)
②Ca + CaCl2=2CaCl(2分)
本题解析:(1)①常温下,铝在浓硝酸中钝化,表面形成致密的氧化膜而隔离铝和浓硝酸,所以可用铝制容器存放浓硝酸。
②首先携程H2与NO2反应的化学方程式并注明状态,然后根据盖斯定律求出?H,?H=2?H1-?H2=-1034 kJ·moL-1,可写出热化学方程式:4H2(g) + 2NO2(g)=N2(g) + 4H2O(g)?△H=-1034 kJ·moL-1
(2)①反应物为CaCl2和H2,根据元素守恒,生成物乙显酸性,则乙为:HCl;化合物甲的组成中钙、氯元素的质量分数分别为52.29%、46.41%,则H元素的质量分数为:1—52.29%—46.41%=1.3%,根据元素质量比可得该化合物的化学式为:CaHCl,与水反应生成H2的反应为:2CaHCl + 2H2O=CaCl2 + Ca(OH)2 + 2H2↑
②Ca具有强还原性,可与CaCl2反应生成CaCl,化学方程式为:Ca + CaCl2=2CaCl
本题难度:一般
2、选择题 四种基本类型反应与氧化还原反应的关系可用下列哪个图所示 (?)?
 ?
?
A? B? C? D
参考答案:B
本题解析:首先复分解反应不涉及价态的改变,所以不包含在氧化还原反应中,排除C,置换反应中有新单质生成,涉及到了价态的改变,所以包含在氧化还原反应中,排除A,分解反应与化合反应有的是氧化还原,有的不是,所以B正确。
点评:本题实际上在考查氧化还原反应的本质,是电子的得失,表现为价态的变化,在四种基本反应中,置换反应价态发生改变,复分解反应不改变,化合与分解不一定发生改变。
本题难度:简单
3、填空题 (7分)在KClO3+6 H Cl(浓)=KCl+3Cl2↑+3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数比是____________,氧化产物与还原产物的质量比是________,反应中被氧化的盐酸和未被氧化盐酸的质量比是?,
试用双线桥法表示上述氧化还原反应_________________________
参考答案:(7分)KClO3,Cl2, 1∶1, 5∶1, 5∶1,(每空1分)
 ?(2分)
?(2分)
本题解析:略
本题难度:一般
4、简答题 一块表面已部分被氧化的金属钠的质量为0.77克,放入100ml水中,得到氢气224ml(标准状况下),
求:(1)金属钠表面的氧化钠的质量是多少?
(2)所得溶液的溶质的物质的量浓度是多少?(忽略溶液体积的变化)
参考答案:(1)n(H2)=0.224L22.4L/mol=0.01mol,
2Na+2H2O=2NaOH+H2↑
46g 1mol
m(Na) 0.01mol
m(Na)=0.46g,则m(Na2O)=0.77g-0.46g=0.31g,
答:金属钠表面的氧化钠的质量是0.31g;
(2)混合物中n(Na)=0.02mol,n(Na2O)=0.31g62g/mol=0.005mol,
则与水反应生成的总NaOH的物质的量为:n(NaOH)=0.2mol+0.01mol=0.03mol,
c(NaOH)=0.03mol0.1L=0.3mol/L,
答:所得溶液的溶质的物质的量浓度是0.3mol/L.
本题解析:
本题难度:一般
5、填空题 (4分)写出下列各化学用语
-CH2CH3?(名称),-NO2?(名称),-OH?(电子式),羧基?(化学符号)
参考答案:(4分)乙基,硝基,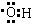 ,-COOH(共2′×4=8分)
,-COOH(共2′×4=8分)
本题解析:略
本题难度:一般