微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示。
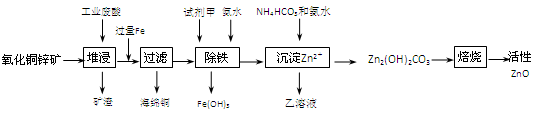
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
离子
| 开始沉淀时的pH
| 完全沉淀时的pH
|
Fe2+
| 6.34
| 9.7
|
Fe3+
| 1.48
| 3.2
|
Zn2+
| 6.2
| 8.0
|
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,这是由于相同温度下:Ksp(CuS)??Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的?(填序号)作为试剂甲是比较合适的。
A.KMnO4? B.HNO3? C.H2O2? D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在?范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方程式?。
(5)298K时,残留在乙溶液中的c(Fe3+)在 __??mol/L以下。
[Fe(OH)3的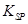 = 2.70×10-39]
= 2.70×10-39]
(6)乙的溶液可直接用作氮肥,则乙的化学式是?。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式?。
2、实验题 (16分)过氧化钙(CaO2)常用作种子消毒剂、药物制造、 油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体
油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体 生成。有人提出:CO2、SO2与过氧化
生成。有人提出:CO2、SO2与过氧化 钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断
钙的反应原理相同;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同。据此设计如下实验操作进行判断 。
。
实验一、通过气体体积的测量判断发生的化学反应,实验装置如下:
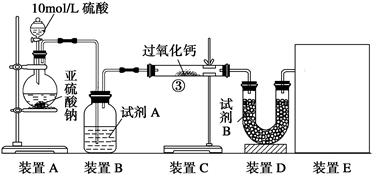
(1)试剂A可以选用?,试剂B为碱石灰其作用是______________________。
(2)装置E用于测定氧气 的体积
的体积 ,请在框中画出装置图。
,请在框中画出装置图。
(3)实验测得装 置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
置C增重m1 g,装置D增重m2 g,装置E中收集到V L气体(已换算成标准状况下),用上述有关测量数据判断,当SO2未氧化时,V与m1或m2的关系式为_________。
若SO2完全氧化,写出反应的化学方程式:___________________________________。
实验二、向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
提出假设:
假设1:反应后固体中只有Na2SO3,SO2未氧化;
假设2:反应后固体中只有Na2SO4,SO2完全氧化;
假设3 :________________________________________________________________。
:________________________________________________________________。
实验探究:
(4)设计实验证明假设3是正确的,简要回答实验过程、现象和结论:________________
____________________________________________________________________________。
实 验评价:
验评价:
(5)实验过程中SO2的通入量直接影响探究实验结果的科学性,请简要说明原因:
____________________________________________________________________________。
3、填空题 为探究乙烯与溴的加成反应:甲同学设计并进行了如下实验:先用乙醇和浓硫酸为原料制取乙烯,将生成的气体直接通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应.乙同学发现在甲同学的实验中,产生的气体有刺激性气味,推测在制得的乙烯中还可能含有少量浓硫酸的还原气体,由此他提出必须先除去,再与溴水反应.
请你回答下列问题:
(1)甲同学设计的实验______(填“能”或“不能”)验证乙烯与溴水发生了加成反应,理由是______.
(2)乙同学推测此乙烯中必定含有的一种杂质气体,它与溴水反应的化学方程式是______.在验证过程中必须全部除去,为此乙同学设计了如图所示的实验装置:
①Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是Ⅰ______;Ⅱ______;Ⅲ______;Ⅳ______;
(选填序号).
A.品红溶液B.NaOH溶液C.浓硫酸D.酸性KMnO4溶液
②乙设计的实验中能确定生成了乙烯的现象是______.
(3)为验证乙烯与溴水的反应是加成反应而不是取代反应,丙同学提出可将上述乙除杂后的气体通入溴水中,用pH试纸测反应后溶液的酸碱性,你认为是否合理______(填合理、不合理),理由是______.
(4)乙烯通入溴水中,观察到的现象是______;其反应方程式为______.

4、选择题 一元硬币的外观有银白的金属光泽,一些同学认为它可能是铁制成的.在讨论时,有同学提出:“我们可以先拿磁铁来吸一下”.就“拿磁铁来吸一下”这一过程而言,属于科学探究中的( )
A.实验法
B.比较法
C.观察法
D.分类法
5、实验题 (13分)铁是生活中的常见金属,也是高中所学的过渡元素,由于其结构特点,在与其化物质反应时往往表现出不同的价态。某研究性学习小组对铁和硫反应产物中铁的化合价进行了探究,并设计了以下实验,其实验的步骤为:
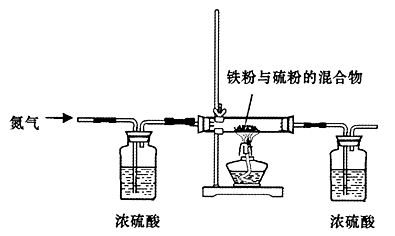
步骤一:将铁粉和硫粉按一定质量比混合,如图所示在氮气环境中,加热后反立即可发生并持续进行,冷却后得到黑色固体。
步骤二:取黑色固体少许,加入浓NaOH溶液并稍稍加热,冷却后过滤,得到黑色滤渣。
在取得黑色滤渣后,同学们经过讨论分析,对其成分提出了各种猜想,其中代表性的为:
猜想一:由于硫和氧是同一主族元素,所以黑色固体的可能是Fe3S4
猜想二:硫和氧虽是同一主族元素,但硫的非金属性弱,则黑色固体为FeS
为了验证以上猜想又进行了以下操作:
步骤三:在滤渣中加入已煮沸的稀硫酸。
步骤四:取步骤三所得溶液少许,……。
请回答下列问题:
(1)查阅资料:实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应得氮气。请写出该反应的离子方程式:?。
(2)实验中通入氮气的作用?。
(3)若猜想一正确,则步骤三应该观察到试管内有?出现(填实验现象)。
(4)若猜想二正确,请完成步骤四的实验操作、现象和结论?。
(5)步骤一中铁粉和硫粉的混合粉末中硫要过量些,其原因是?。
(6)步骤二中加入浓NaOH溶液并稍稍加热的目的是?。