微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向某晶体的溶液中加入含Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,由此得出下列的结论错误的是? ( )。
A.Fe3+的氧化性比溴的氧化性强
B.该晶体中一定含有SCN-
C.Fe2+与SCN-不能形成红色化合物
D.Fe2+被溴氧化成Fe3+
参考答案:A
本题解析:某晶体的溶液中没有与Fe2+发生反应显红色的离子,当加入溴水后,Fe2+一定被氧化成Fe3+,此时溶液出现红色,说明原晶体是含有SCN-的盐,很明显判断出B、C、D均正确,在Br2与Fe2+反应中,Fe3+是氧化产物,Br2是氧化剂,所以Br2的氧化性应比Fe3+氧化性强。
本题难度:一般
2、填空题 铜是生命必需的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。请完成(1)~(3)题:
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)与铁反应生成铜]。试写出该反应的化学方程式: _____________________________。
(2)铜器表面有时会生成铜绿,请写出生成铜绿的化学方程式:____________________________。
这层铜绿可以用化学方法除去,试写出除去铜绿而不损伤器物的化学方程式: _________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币。试从物理性质和化学性质的角度分析为什么铜常用于制造货币。(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃)_________________ ___________。
参考答案:(1)Fe+CuSO4=FeSO4+Cu
(2)2Cu+O2+H2O+CO2=Cu2(OH)2CO3
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
(3)选择铜做货币是因为铜的熔点比较低,容易铸造成型;铜的化学性质比较稳定,不易被腐蚀
本题解析:本题考查有关铜的冶炼方法、铜化合物的性质,同时考查了有关铜的
应用。一方面要注意铜的性质很稳定,不易发生化学反应。但又应知道这种
稳定性是相对的,在适宜条件下也会与一些物质反应。
本题难度:一般
3、实验题 (12分)铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(杂质中不含铁元素,且杂质不与H2、H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
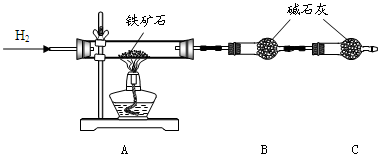
实验结果:将5.0g铁矿石放入硬质玻璃管中完全反应, 测得装置B增重1.35 g。
Ⅱ.铁矿石中含铁量的测定
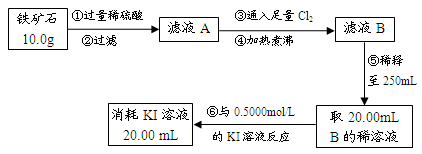
Ⅲ.问题讨论与解决:
(1)如要验证滤液A中铁元素的存在形式,可另取两份滤液A分别进行实验,实验方法、现象与结论如下表。请将其补充完整。
可供选择的试剂有:酸性KMnO4溶液、NaOH溶液、KSCN溶液、氯水
实验方法
| 实验现象
| 结论
|
步骤1:在滤液A中加入?
| ?
| 滤液A中有Fe3+
|
步骤2:在滤液A中加入?
| ?
| 滤液A中有Fe2+
|
(2)步骤④中煮沸的作用是:?;
(3)步骤③中反应的离子方程式为:?;
(4)请通过实验Ⅰ、Ⅱ计算出该铁矿石中铁的氧化物的化学式。(写出计算过程)
参考答案:(1)
实验方法
实验现象
结论
加入? KSCN溶液?(1分)
?溶液呈血红色?
(1分)
加入?酸性KMnO4溶液?(1分)?
?KMnO4溶液褪色?
(1分)
?
(2)除去滤液A中过量的Cl2? (2分)
(3)2Fe2++Cl2 = 2Fe3++2 Cl-? (2分)
(4)10g矿石中:n(O)=0.15mol? (1分)
10g矿石中:n(Fe)= n(Fe3+) = 0.125mol? (2分)
n(Fe):n(O)=" 0.125mol:" 0.15mol =5:6?即化学式为:Fe5O6?(1分)
本题解析:⑴根据供选试剂,用KSCN溶液检验滤液A中含有Fe3+(溶液呈血红色);用酸性KMnO4溶液检验滤液A中含有Fe2+(溶液褪色);
⑵加入足量氯气后加热煮沸,能将反应液中过量的氯气除去,防止与步骤⑥中KI反应给实验结果带来干扰;
⑶步骤③用氯气将Fe2+氧化为Fe3+;
⑷在10g矿石中:n(O)=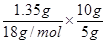 =0.15mol;
=0.15mol;
在10g矿石中:n(Fe)= n(Fe3+) =n(I-)= = 0.125mol;
= 0.125mol;
则n(Fe):n(O)= 0.125mol::0.15mol =5:6; 即化学式为:Fe5O6 。
本题难度:一般
4、填空题 现有浓度均为1 mol·L-1的FeCl3、FeCl2、CuCl2的混合溶液各100 mL,加入一定量的铁粉,按下列情况填空:
(1)反应完毕后,铁粉有剩余。
①反应完毕后,溶液中一定含有_____________阳离子,为_____________mol,一定没有?_____________?阳离子;
②固体物质干燥后,其中一定有_____________,与反应前加入铁粉质量相比_____________(填“多”或“少”)_____________g。
(2)反应完毕后,有铜生成,铁粉无剩余。则反应完毕 后溶液一定含有_____________阳离子,该阳离子在溶液中的物质的量范围是_____________。
参考答案:(1)Fe2+? 0.35? Fe3+、Cu2+
②Fe、Cu?少? 2
(2)Fe2+? 0.25 mol<n(Fe2+)≤0.35 mol
本题解析:混合液中n(FeCl3)=n(FeCl2)=n(CuCl2)="0.1" mol,加入铁粉后能发生如下反应:
Fe+2Fe3+====3Fe2+,Fe+Cu2+====Fe2++Cu
(1)铁粉过量时,Fe3+和Cu2+完全反应且生成单质Cu。Fe+2Fe3+====3Fe2+反应产生的n(Fe2+)="0.15" mol,消耗n(Fe)="0.05" mol;
Fe+Cu2+====Fe2++Cu产生的n(Fe2+)="0.1" mol,消耗n(Fe)="0.1" mol,置换出Cu 0.1 mol。
所以溶液中n(Fe2+)="0.1" mol+0.15 mol+0.1 mol="0.35" mol
消耗Fe与置换出Cu的质量差为(0.1 mol+0.05 mol)×56 g·mol-1-0.1 mol×64 g·mol-1="2" g。
(2)采用“极端假设法”分析。若Cu2+不反应,溶液中n(Fe2+)="0.1" mol+0.15 mol="0.25" mol;若Cu2+完全反应,溶液中n(Fe2+)="0.35" mol。所以0.25 mol<n(Fe2+)≤0.35 mol。
本题难度:简单
5、选择题 在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是
A.白色沉淀是BaSO4和BaSO3
B.溶液的酸性减弱
C.白色沉淀是BaSO3
D.FeCl3全部被还原为FeCl2
参考答案:D
本题解析:由于氯化铁具有氧化性,能氧化SO2,生成硫酸和氯化亚铁,所以白色沉淀是硫酸钡,所以选项D正确,答案选D。
本题难度:一般