微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 (NH4)2SO4在加热条件下分解,生成NH3、SO2、N2和H2O.反应中生成的氧化产物和还原产物的物质的量之比为( )
A.1:3
B.2:3
C.1:1
D.4:3
参考答案:A
本题解析:
本题难度:简单
2、选择题 把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是?
[? ]
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2,且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以Al(OH)3的形式存在
参考答案:A
本题解析:
本题难度:一般
3、选择题 从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7X+5FeSO4+12H2SO4,下列说法正确的是
A.X的化学式为CuS,它既是氧化产物又是还原产物
B.5molFeS2发生反应,有10mol电子转移
C.产物中的SO42-离子有一部分是氧化产物
D.FeS2只作还原剂
参考答案:C
本题解析:试题分析:由元素守恒可得出X为Cu2S,通过化合价的变化可知Cu2S既是氧化产物又是还原产物。14molCuSO4与5molFeS2发生反应中,14mol铜原子由+2价降低为+1价,5molFeS2中共10mol硫原子,其中的7mol硫原子由-1价降为-2价,共降价21,另3mol硫原子由-1价升高为+6价,共升价21,故有21mol电子转移。
考点:考查基本理论,氧化还原反应
本题难度:困难
4、选择题 在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中(a、b、c、d、e、f是各物质的化学计量数),若0.3molH2O被氧化,则被水还原的BrF3的物质的量是( )
A.0.15mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:在反应aBrF3+bH2O=cHBrO3+dHBr+eHF+fO2中,元素化合价变化情况为:溴元素由+3价升高为+5价,溴元素由+3价降低为-1价,氧元素化合价由-2价升高为0价,所以BrF3既起氧化剂也起还原剂作用,同时水也起还原剂作用.若0.3molH2O被氧化,氧原子提供电子物质的量为0.3mol×2,令被水还原的BrF3的物质的量为xmol,根据电子转移守恒,则:
0.3mol×2=xmol×[3-(-1)]
解得x=0.15
故选:A.
本题解析:
本题难度:一般
5、选择题 在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则生成lmo1Cr2O72-?所需PbO2的物质的量为
A.3.0mo1
B.1.5mo1
C.1.0mo1
D.0.75mo1
参考答案:A
本题解析:分析:PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,化合价变化为: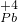 O2→
O2→ 2+,
2+,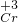 3+→
3+→ 2O72-,根据氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.
2O72-,根据氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.
解答:PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,化合价变化为: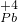 O2→
O2→ 2+,
2+,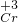 3+→
3+→ 2O72-,
2O72-,
氧化还原反应中氧化剂与还原剂得失电子数目相等,表现为化合价升降总数相等,设所需PbO2的物质的量为x,则
1mol×2×(6-3)=x×(4-2),
x=3.0mol,
故选A.
点评:本题考查氧化还原反应,题目难度不大,注意根据化合价的变化结合氧化还原反应中氧化剂与还原剂得失电子数目相等进行计算.
本题难度:困难