微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用右图所示装置进行实验,下列对实验现象的解释不合理的是

?
| ①中试剂
| ①中现象
| 解?释
|
A
| Ba(NO3)2溶液
| 生成白色沉淀
| SO32-与Ba2+生成白色BaSO3沉淀
|
B
| 品红溶液
| 溶液褪色
| SO2具有漂白性
|
C
| 紫色石蕊溶液
| 溶液变红
| SO2与水反应生成酸
|
D
| 酸性KMnO4溶液
| 紫色褪去
| SO2具有还原性
|
?
参考答案:A
本题解析:A.Cu与浓硫酸发生反应产生SO2气体,将SO2气体通入到Ba(NO3)2溶液由于硝酸有强的氧化性,会把BaSO3氧化成BaSO4沉淀。错误。其它选项的试剂、现象及原因都正确。2气体的制备及化学性质的知识。
本题难度:一般
2、选择题 硫和浓氢氧化钠溶液共热至沸,反应后,硫转化为S2-、SO32-,则反应的S和生成的S2-、SO32-的物质的量比为?
A.2∶1∶1
B.3∶2∶1
C.3∶1∶2
D.4∶1∶3
参考答案:B
本题解析:因为S由反应前的零价变为反应后的-2价(S2-)和+4价(SO32-),硫和强碱发生了氧化还原反应,由题意可写出下列反应方程式:
3S+6NaOH====2Na2S+Na2SO3+3H2O,所以参加反应的S,S2-,SO32-物质的量之比为3∶2∶1。
本题难度:一般
3、实验题 测定生成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知SO3的熔点是16.8oC,沸点是44.8oC)
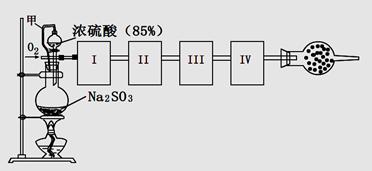
(1)装置中甲管的作用是__________________。
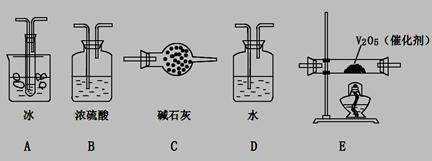
(2)根据实验需要,应该在I、II、III、IV处连接合适的装置,请从下图A?E装置中选择最适合装置并将其序号填至下面的空格中,每个装置不重复使用。
I、 II、III、IV处连接的装置分别是?。
(3)为使SO2有较高的转化率,实验中加热催化剂与滴加浓硫酸的顺序中,应采取的操作是____________ ,若用大火加热烧瓶时,SO2的转化率会____________ (填“升高”、“不变”或“降低”)。
(4)有一小组在实验中发现,SO2气体产生缓慢,以致后续实验现象不明显,但又不存在气密性问题,请你推测可能的原因(可以不填满)①原因:______? ②原因 :______?③原因:______
(5)将SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为?
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置IV增重了 mg,则实验中SO2的转化率为?。(用含m、n的代数式填写)
参考答案:(1)让硫酸顺利流下。(意思对,或答保持分液漏斗和烧瓶内压强相等也给分)
(2)BEAC
(3)先加热催化剂再加浓硫酸?降低
(4)①Na2SO3变质( 分),②浓硫酸的浓度不够(其他合理答案均给分)
(5)SO2+2HClO3=H2SO4+2ClO2
(6)(64n-m)/64n×100%(其他合理答案均给分)
本题解析:(1)橡胶管的作用是平衡压强,使液体顺利流下。(2)生成的二氧化硫气体通过浓硫酸干燥后通过五氧化二矾催化剂发生反应,然后将混合气体通过冰冷凝三氧化硫,二氧化硫被碱石灰吸收。(3)为提高二氧化硫转化率,催化剂应预先加热,使生成的二氧化硫立即与氧气发生反应;若大火加热,二氧化硫反应不完全,转化率低。(4)亚硫酸钠与85%硫酸反应生成二氧化硫,随着反应进行,硫酸浓度变稀,导致后续现象不明显;也可能亚硫酸钠部分变质为硫酸钠导致二氧化硫气体产生缓慢。(5)二氧化硫通过含1molHClO3溶液,转移1mol电子,说明HClO3还原产物为ClO2,所以二氧化硫被氧化为硫酸。(6)nmolNa2SO3与足量浓硫酸生成nmolSO2,装置IV增重mg说明未反应的SO2为m/64mol,所以二氧化硫转化率为(64n-m)/64n。
点评:本题实验原理是二氧化硫与氧气催化氧化生成三氧化硫,二氧化硫由亚硫酸钠与浓硫酸反应得到,最好再增加一个提供氧气的装置更好,因系统中氧气毕竟有限。
本题难度:困难
4、填空题 (15分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一?焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
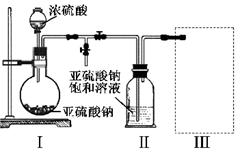
(1)装置I中产生气体的化学方程式为?。
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是?。
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为?(填序号)。

实验二?焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-?的电离程度大于水解程度,可采用的实验方法是?(填序号)。
a.测定溶液的pH? b.加入Ba(OH)2溶液? c.加入盐酸?
d.加入品红溶液? e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是?。
实验三?葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为?g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果?(填“偏高”“偏低”或“不变”)。
参考答案:
⑴Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O
⑵过滤?⑶d?⑷a、e
⑸取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成
⑹①0.16?②偏低
本题解析:⑴装置I中浓硫酸与亚硫酸钠反应产生二氧化硫气体,同时生成硫酸钠和水,根据观察法将其配平。
⑵装置Ⅱ中析出Na2S2O5晶体,通过过滤操作得到该晶体。
⑶处理过量的SO2尾气,A项装置瓶口封闭,错误;B项食盐水不能将大量的SO2尾气吸收,错误;C项漏斗口没入了液体中,错误,D项氢氧化钠溶液可吸收SO2尾气,同时能防倒吸,正确。
⑷若NaHSO3溶液中HSO3-?的电离程度大于水解程度,则所得溶液显弱酸性,可通过测定溶液的pH(pH<7),用蓝色石蕊试纸检测(显红色)等途径来证明。
⑸若Na2S2O5晶体在空气中已被氧化,则应该生成Na2SO4,通过检验样品中是否含有SO42-即可。
⑹①根据反应“SO2+I2+2H2O=H2SO4+2HI”,则样品中抗氧化剂的残留量=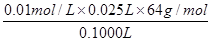 =0.16 g/L。
=0.16 g/L。
②若有部分HI被空气氧化又生成I2,导致消耗标准I2溶液的体积偏小,则测得结果偏低。
本题难度:一般
5、实验题 下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,填写下列空白。
(1)如下图将装置中①②③三部分仪器的连接顺序变为②①③,则可以检验出的物质
是___________;不能检验出的物质是___________。
(2)如果将仪器的连接顺序变为①③②,则可以检验出的物质是___________;不能检验出的物质是___________。

(3)如果将仪器的连接顺序变为②③①,则可以检验出的物质是___________;不能检验出的物质是___________。
参考答案:(1)SO2、CO2?H2O? (2)H2O?SO2、CO2? (3)SO2、CO2?H2O
本题解析:浓H2SO4与木炭反应式为
C+2H2SO4(浓)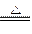 CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
随CO2与SO2逸出的还有H2O(g)。
①可用来检验并除H2O(g);②可用来检验并除去SO2;③可用来检验CO2。但即使干燥的气体,通过②或③后也会带出H2O(g)。
试题采用变式训练的模式,设计出了检验反应产物的三套错误装置,实为考查实验设
计和物质性质判定能力。试题新颖,难度适中,能较好地考查实验能力和思维能力,具有较好的导向。
本题难度:简单