微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出),大部分反应在工业生产中得到实际应用。已知Ⅰ、G是单质,且Ⅰ是一种既能与酸反应又能与碱反应生成氢气的金属,L是一种无色气体,K是一种红棕色气体,E是一种红褐色沉淀。
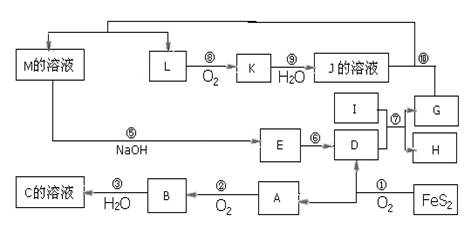
请填写下列空白:
(1)写出下列物质的化学式:C:?;J:?。
(2)写出下列反应的化学反应方程式:
反应⑦:?。
反应⑩:?。
(3)写工业上NH3与O2在一定条件下制取L的化学方程式:?。
参考答案:(每空2分,共10分,条件未写扣一分)
(1)C:H2SO4?J: HNO3?
(2)反应⑦ :? Fe2O3 ?+ 2Al  ?Al2O3 + 2Fe
?Al2O3 + 2Fe
反应⑩:Fe + 4HNO3 = Fe(NO3)3 +NO↑ +2 H2O
(3)4NH3 + 5O2 4NO + 6H2O
4NO + 6H2O
本题解析:I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属,判断为Al,K是一种红棕色气体,判断为NO2;D的俗名叫铁红为Fe2O3;,A是形成酸雨的主要气体为SO2,由反应4FeS2+11O2  2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,分别为:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2;题目所涉及的问题可顺利解决。
2Fe2O3+8SO2知A、D为Fe2O3、A为SO2,结合A+O2 →B知,A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I是既能与强酸反应生成氢气又能与强碱反应生成氢气的金属为Al;G、H为Al2O3和Fe中的一种;由K是一种红棕色气体,K为NO2,J为HNO3,L为NO;又由G+HNO3 →M+NO↑分析知G为Fe,H为Al2O3;M应为Fe(NO3)3或Fe(NO3)2;联系反应④:M+H2SO4 →F+NO↑知,M为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;E应为Fe(OH)3,至此全部物质已确定,分别为:A、SO2;B、SO3;C、H2SO4;D、Fe2O3;E、Fe(OH)3;F、Fe(NO3)3或Fe2(SO4)3;G、Fe;H、Al2O3;I、Al;J、HNO3;K、NO2;L、NO;M、Fe(NO3)2;题目所涉及的问题可顺利解决。
(1)依据题干条件和推断,A是酸雨主要成分为:SO2,A+O2→B,B+H2O→C,推知C为H2SO4;D为铁红Fe2O3,E为Fe(OH)3,J为HNO3。
(2)反应⑦的化学方程式为铝热反应,化学方程式为:Fe2O3+2Al Al2O3+2Fe。
Al2O3+2Fe。
反应⑩的方程式为:Fe + 4HNO3 = Fe(NO3)3 +NO↑ +2 H2O。
(3)根据教材知识书写其方程式为4NH3 + 5O2 4NO + 6H2O。
4NO + 6H2O。
点评:本题考查了无机化合物的性质转化关系和性质应用,主要利用特征现象进行分析推断各物质,抓住题眼①和题干信息,结合反应和转化关系判断出各物质是解题关键。
本题难度:一般
2、填空题 某些化学反应可用下式表示:A+B→C+D+H2O
请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为?(填化学式下同)。反应的化学方程式为?。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为?。反应的化学方程式为?。
(3)若A为紫红色金属,D为有色气体。则A为?。反应的离子方程式为?。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为?。反应的离子方程式为?。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为?。反应的化学方程式为?。
参考答案:(1)Cl2;2NaOH+Cl2=NaCl+NaClO+H2O
(2)C;C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
CO2↑+2SO2↑+2H2O (3)Cu;Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
(4)CaCO3;2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-
(5)NH3;Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
CaCl2+2NH3↑+2H2O↑(水的气体箭头不作要求)
本题解析:(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为Cl2。B是氢氧化钠,则该反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊,则气体应该是CO2和SO2,所以A为C,B是浓硫酸,该反应的化学方程式为C+2H2S O4(浓) CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
(3)若A为紫红色金属,则A是Cu;D为有色气体,则D可能是NO2,因此该是浓硝酸与铜发生的氧化还原反应,所以该反应的离子方程式为Cu+4H++2NO3-=Cu2++2H2O+2NO2↑。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,则C是碳酸钙,化学式为CaCO3。D为正盐,则D为碳酸盐,B就是碳酸氢钠盐,所以该反应的离子方程式为2OH-+Ca2++2HCO3-=2H2O+CaCO3↓+CO32-。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色,说明C溶液显碱性。实验室常用此反应制备C气体,则C为NH3。因此该反应的化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
本题难度:一般
3、推断题 已知甲、乙、丙是三种常见的单质,且组成它们的三种元素的核电荷数之和为35,A到H是八种常见的化合物。上述各物质间的相互关系如下图所示(反应条件省略)
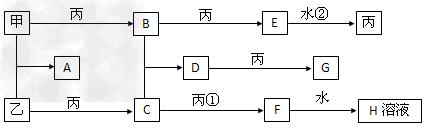
试回答: ?
(1)丙的化学式?___________。 ?
(2)用电子式表示A的形成过程____________________。 ?
(3)写出①②两步的化学方程式
①______________________②___________________。
参考答案:(1)O2
(2)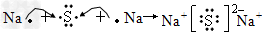
(3)①2SO2+O2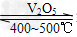 2SO3;②2Na2O2+2H2O==4NaOH+O2↑
2SO3;②2Na2O2+2H2O==4NaOH+O2↑
本题解析:
本题难度:一般
4、推断题 A、B、C、D均为中学常见物质,其中A为单质,B、C、D为化合物,并且存在如下转化关系

试回答下列问题:
(1)B与C为氧化物,D是一种盐,俗名纯碱。
①若A为金属单质,写出反应④的化学方程式为________________________
②若A为非金属单质,则符合转化④的一个反应的离子方程式为________________________
(2)若A为淡黄色非金属单质,B为气态氧化物,是空气的重要污染物之一,C为气态氢化物。试写出B与C反应的化学方程式:________________________
(3)若A为金属单质,常用于制作燃烧弹、信号弹,C为氧化物,且反应①③均需加入强碱溶液才能发生,则反应①的离子方程式为__________________________
参考答案:(1)①2Na2O2+2CO2=2Na2CO3+O2;②CO2+2OH-=CO32-+H2O
(2)2H2S+SO2=3S↓+2H2O
(3)2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑或2Al+2OH-+2H2O=2AlO2-+3H2↑
本题解析:
本题难度:一般
5、填空题 下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件和产物未列出。已知C、D、E、H是常见的气体且D为单质。反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法,反应⑥是J的失效反应原理。 ?
?
请回答下列问题:
⑴物质L的电子式为____________,E的结构式为_______________。
⑵D所含元素位于周期表__________________,生产D的工业被称为_______________。
⑶反应⑤的化学方程式为___________________________________________。
反应⑥的离子方程式为___________________________________________。
⑷物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为________。
参考答案:⑴? ?O=C=O(2分)⑵第三周期VIIA族,氯碱工业(2分)
?O=C=O(2分)⑵第三周期VIIA族,氯碱工业(2分)
⑶Ca(OH)2+2NH4Cl ?CaCl2+2NH3↑+2H2O(2分)
?CaCl2+2NH3↑+2H2O(2分)
Ca2++2ClO—+CO2+H2O=CaCO3↓+2HClO(2分)? ⑷CaCN2(2分)
本题解析:本题突破口为:反应⑥是J的失效反应原理,中学阶段只有漂白粉符合题意,∴J为Ca(ClO)2。又知D为常见气体单质,D+I→J+K+H2O,且反应②④是工业生产中的重要反应,可推知,D为Cl2,I为Ca(OH)2,④是工业制漂白粉的重要反应。∵F+H2O→I,∴F为CaO, B为CaCO3,②为工业煅烧石灰石。再由反应⑤是实验室制备气体C的重要方法,I+G →C+K+H2O∴C为氨气,G为NH4Cl,C+H→NH4Cl,所以H为HCl。本题难点是确定物质A组成,由1molA与水反应生成1molB和2molC知:A+H2O→CaCO3+2NH3,据原子守恒知H2O系数为3,∴A为CaCN2。
本题难度:一般