微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向一定量的Fe、FeO、 Fe2O3的混合物中,加入100 mL l mol/L的盐酸;恰好使混合物完全溶解并放出标准状况下224 mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
[ ? ]
A.11. 2 g
B.2.8 g
C.5.6 g
D.无法计算
参考答案:B
本题解析:
本题难度:一般
2、选择题 将足量的Cu片放入25mL 18.4mol/L的H2SO4溶液中,加热使其充分反应后,被还原的H2SO4的物质的量?
[? ]
A.等于0.23mol
B.小于0.23mol
C.等于0.46mol
D.在0.23~0.46mol之间
参考答案:B
本题解析:
本题难度:一般
3、选择题 将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况)。则所消耗硝酸的物质的量是
[? ]
A、0.12 mol
B、0.11 mol
C、0.09 mol
D、0.08 mol
参考答案:B
本题解析:
本题难度:一般
4、选择题 在4 mol·L-1 的硫酸和2 mol·L-1的硝酸混合溶液10 mL中,加入0.96 g铜粉,充分反应后最多可收集到标况下的气体的体积为
[? ]
A.89.6 mL
B.112 mL
C.168 mL
D.224 mL
参考答案:D
本题解析:
本题难度:一般
5、计算题 用8.7 g MnO2和10 mol/L的盐酸120 mL反应制取Cl2。
(1)在标准状况下可生成多少升氯气?
(2)若把反应后的剩余溶液稀释成1L后,取出20 mL(不考虑HCl损失),在这20 mL溶液中加入足量AgNO3溶液,可得AgCl多少克?
参考答案:(1)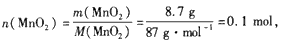
n( HCl)=10 mol/L×0.12L=1.2mol,
MnO2? +? 4HCl(浓) MnCl2+Cl2↑+2H2O?
MnCl2+Cl2↑+2H2O?
?1? ?4
0.1mol? 1.2 mol
盐酸过量,依MnO2的量来计算。
n(Cl2)=n(MnO2)= 0.1 mol,
故V(Cl2)=0.1 mol×22.4 L.mol-1=2. 24 L。
(2)由(1)可知n(Cl2)=0.1 mol,根据氯元素守恒,有:
n(Cl-)=n(HCl)-2n(Cl2)=1.2mol -2×0.1mol=1 mol。
在20 mL溶液中,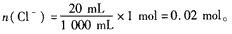
依 Cl-~AgCl,有:n(AgCl)=n(Cl-)=0. 02 mol。
故m( AgCl) = 0. 02 mol×143. 5g.mol-1=2. 87 g。
本题解析:
本题难度:一般