微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程中的有关问题。
(1)工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:____? ______________。
(2)铁在潮湿的空气中容易被腐蚀为铁锈(Fe2O3·xH2O),反应的化学方程式为_____________ ___? _________。
(3)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被完全除尽后,溶液中继续发生的化合反应的化学方程式为____________________________。
参考答案:(6分)(1)3CO+Fe2O32Fe+3CO2
(2)4Fe+3O2+2xH2O=2Fe2O3·xH2O(或其他合理答案)? (3)2FeCl3+Fe=3FeCl2
本题解析:略
本题难度:一般
2、选择题 如下图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为
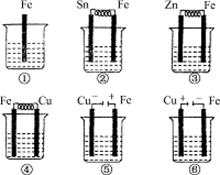
A.②①③④⑤⑥
B.⑤④③①②⑥
C.⑤④②①③⑥
D.⑤③②④①⑥
参考答案:C
本题解析:根据装置图可知,①是铁的缓慢氧化,②③④分别构成原电池,其中②④中铁是负极,由于铁和铜金属性相差大,所以④中反应速率快,③中铁是正极;⑤⑥是电解池,其中⑤中铁是阳极,⑥中铁是阴极,被保护。因此正确的答案选C。
本题难度:困难
3、选择题 我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为
2H2O+O2+4e-=4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe-2e-=Fe2+
参考答案:B
本题解析:由于该城市出现了严重的酸雨,因此铁制品既可以直接与H+反应生成H2,
也可以形成原电池,发生析氢腐蚀,正极反应为2H++2e-=H2↑。
本题难度:一般
4、填空题 钢铁的生产和使用是人类文明和生活进步的一个重要标志。
(1)金属制品中的镀锡铁皮(马口铁)和镀锌铁皮(白铁皮)镀层部分破坏后,在潮湿的环境中,?(填“马口铁”或“白铁皮”)更易锈蚀。
(2)人们常用氧化铁进行铝热反应来焊接钢轨,写出该铝热反应的化学方程式:
?。
(3)炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑。
①铁锅所发生的腐蚀主要是?腐蚀。
②铁锅锈蚀的正极反应式为?。
(4)为防止轮船的船体在海水中腐蚀,一般在轮船身上装有一定数量的?(填“锌”或“铜”)块。
(5)工业炼铁原理的主要化学反应方程式(即赤铁矿生成铁)为?。
参考答案:(1)马口铁
(2)
(3)吸氧?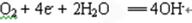
(4)锌
(5)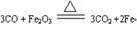
本题解析:(1)马口铁中铁活泼,白铁皮中锌活泼,故在潮湿的环境中,马口铁更易锈蚀。
(2)铝和氧化铁在加热条件下反应的方程式为 。
。
(3)①铁在中性环境下主要发生的是吸氧腐蚀。
②正极得到电子,化合价降低,反应式为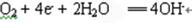 。
。
(4)锌比铁活泼,铜比铁不活泼,故选用锌块。
(5)工业炼铁原理是用CO高温还原氧化铁,方程式为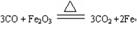 。
。
点评:本题重在重在考查身边化学,更加贴近生活和生产,可以使学生感受到“生活处处有化学”.这也是中考的题型之一。
本题难度:一般
5、选择题 下列说法正确的是(?)
A.镀层破损后,白铁皮(镀锌铁板)比马口铁(镀锡铁板)更耐腐蚀
B.埋在潮湿地下的铁管道比地上的铁管道更耐腐蚀
C.钢铁发生析氢腐蚀时,正极上发生的电极反应式为:Fe-e-= Fe3+
D.在钢铁表面涂上一层油漆,不能达到防止钢铁锈蚀
参考答案:A
本题解析:在潮湿的环境中钢铁更易生锈,B不正确;原电池中负极是失去电子,正极得到电子,C不正确;油漆能隔绝空气,能达到防止钢铁锈蚀,D不正确,所以正确的答案选A。
点评:原电池的正负极的判断(从原电池反应实质角度确定):
(1)由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
(2)由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
本题难度:一般