微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 钢铁在潮湿的空气中会发生吸氧腐蚀。以下说法中,正确的是
A.负极发生的反应为:Fe-2e-=Fe2+
B.正极发生的反应为:O2+4e-+4H+=2H2O
C.腐蚀过程中,电子从正极流向负极
D.钢柱在水下部分比在空气与水交界处更容易发生吸氧腐蚀
参考答案:A
本题解析:
正确答案:A
A.正确,铁作还原剂;
B.不正确,正极发生的反应为:O2+4e-+2H2O=4OH― ;
C.不正确,腐蚀过程中,电子从负极流向正极
D.不正确,钢柱在空气与水交界处更容易发生吸氧腐蚀,更符合腐蚀所需的条件。
本题难度:简单
2、选择题 铁钉和碳棒用导线连接后浸入0.01 mol·L-1的食盐溶液中,可能发生
[? ]
A.碳棒附近聚集OH-
B.碳棒上放出Cl2
C.铁钉被氧化
D.碳棒上放出O2
参考答案:C
本题解析:
本题难度:简单
3、填空题 (12分)某课外活动小组同学用如图装置进行实验,试回答下列问题。
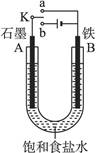
(1)若开始时开关K与a连接,则B极的电极反应式为?。
(2)若开始时开关K与b连接,则其总反应的离子方程式为?。
(3)若用此装置进行电解K2SO4溶液的实验,试回答以下问题:
①开关K应?与连接,
②若标准状况下A极产生2.24 L气体,则溶液中转移?_mol电子
③反应一段时间后,溶液的pH?(填变大、变小或不变),若要电解质溶液复原,
需向溶液中加入的物质为?(填化学式)。
参考答案:(14分)
(1)Fe-2e-====Fe2+?(2) 2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(3)b?0.4mol?③不变? H2O
本题解析:考查原电池、电解池的原理、判断及其应用。
(1)K与a连接则构成原电池,活泼金属作负极,即铁是负极,石墨是正极,因此是铁的吸氧腐蚀,B极的电极反应式为:Fe-2e-====Fe2+。
(2)开关K与b连接,则构成电解池,电解饱和食盐水。石墨和电源正极相连,作阳极,氯离子放电生成氯气。铁和电源负极相连,作阴极,氢离子发生,生成氢气,总反应式为2Cl- + 2H2O  2OH- + H2↑ + Cl2↑。
2OH- + H2↑ + Cl2↑。
(3)①电解池应该有外接电源,所以开关K应与b相连
②电解总方程式为:H2O 2H2+O2↑,当阳极产生氧气2.24 L时,电路中有0.4mol电子的转移;
2H2+O2↑,当阳极产生氧气2.24 L时,电路中有0.4mol电子的转移;
③由于原溶液为中性,电解本质是水的减少,所以电解过程中溶液的pH不变,若要电解质溶液复原,只需向溶液中加适量的水即可。
本题难度:一般
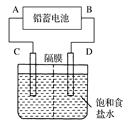
4、填空题 下图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。
已知:铅蓄电池在放电时发生下列电极反应
负极 Pb+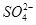 -2e-===PbSO4
-2e-===PbSO4
正极 PbO2+4H++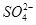 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式?。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,说明蓄电池的A极为________极。
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g·cm-3)时,
①若收集到11.2 L(标准状况下)氯气,则至少转移电子________mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为________L。
参考答案:(8分)(1)2NaCl+2H2O 2NaOH+Cl2↑+H2↑? (2)正 (3)①1 ②22.4
2NaOH+Cl2↑+H2↑? (2)正 (3)①1 ②22.4
本题解析:(1)惰性电极电解饱和食盐水的化学方程式为2NaCl+2H2O 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(2)若在电解池中C极一侧滴2滴酚酞试液,电解一段时间后未呈红色,这说明C电极应该是电解池的阳极,溶液中的氯离子放电,所以蓄电池的A极为正极。
(3)①氯气的物质的量是11.2L÷22.4L/mol=0.5mol,则根据电极反应式2Cl--2e-=Cl2↑可知,反应中转移电子的物质的量是0.5mol×2=1.0mol。
②根据蓄电池的电极反应式可知,消耗2mol硫酸,反应中就转移2mol电子。所以若蓄电池消耗H2SO4 2 mol,则反应中转移2mol电子,因此根据电极反应式2H++2e-=H2↑可知,可收集到H2的物质的量是1mol,其体积(标准状况下)为22.4L。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固与训练,有利于培养学生灵活运用基础知识解决实际问题的能力,有助于提高学生的应试能力和学习效率。
本题难度:一般
5、填空题 如图所示水槽中试管内有一枚铁钉,放置数天后观察:
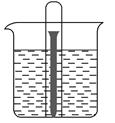
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于________腐蚀。
(2)若试管内液面上升,则原溶液呈________性,发生________腐蚀,电极反应式为:负极:____________________,正极:____________________。
(3)若试管内液面下降,则原溶液呈________性,发生________腐蚀。电极反应式为,负极:____________________,正极:____________________。
参考答案:(1)电化学 (2)弱酸性或中 吸氧
2Fe-4e-=2Fe2+ O2+2H2O+4e-=4OH-
(3)较强的酸 析氢 Fe-2e-=Fe2+ 2H++2e-=H2↑
本题解析:根据原电池的构成条件:有两种不同的材料(Fe为负极,碳为正极),有电解质溶液,形成闭合回路;可知铁钉的腐蚀属于电化学腐蚀。根据金属腐蚀的条件原理及结果可知:试管内液面上升,说明是试管内压强减小,试管内气体被吸收所致,是铁钉吸氧腐蚀的结果,据此写出电极反应式;试管内液面下降,说明是试管内气体压强变大,试管内产生了新气体所致,是铁钉析氢腐蚀的结果,据此写出电极反应式。
本题难度:一般