微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有两种配合物A和B,它们的组成为Co:21.95%,Cl:39.64%,N:26.08%, H:6.38%,O:5.95%,并根据下面的实验结果确定它们的配离子、中心离子和配位数。
(1)A和B的水溶液都呈微酸性,加入强碱并加热至沸腾时,有氨气放出,同时析出CO2O3沉淀。
(2)向A和B的溶液中加入硝酸银溶液时都生成AgCl沉淀。
(3)过滤除去两种溶液中的沉淀后,再加硝酸银均无变化,但加热至沸腾时,在B的溶液中又有AgCl沉淀生成,其质量是原来析出沉淀质量的一半。
________________________________
参考答案:A:[Co(NH3)5(H2O)]Cl3 配离子:[Co(NH3)5(H2O)]3+ 配位数:6 中心离子:Co3+
B:[Co(NH3)5Cl]Cl2 H2O 配离子:[Co(NH3)5Cl]2+ 配位数:6 中心离子:Co2+
H2O 配离子:[Co(NH3)5Cl]2+ 配位数:6 中心离子:Co2+
本题解析:
本题难度:一般
2、选择题 配离子[Cu(NH3)4]2+中,中心离子的配位数是
[? ]
A.1
B.2
C.4
D.6
参考答案:C
本题解析:
本题难度:简单
3、填空题 下图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题
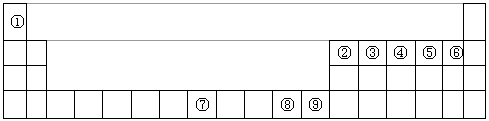
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,①元素位于周期表的________区。
(2)②、⑥两元素形成的化合物的空间构型为________,其中心原子的杂化轨道类型为________。
(3)写出元素⑧基态原子的电子排布式________________。
(4)⑧的二价阳离子与过量的④的氢化物的水化物作用的离子方程式为:________________________。
(5)元素⑦与CO可形成的X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为
103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型)。
(6)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
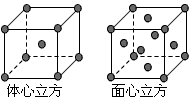
(7)金属⑦的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。则面心立方晶胞和体心立方晶胞中实际含有的原子个数之比为________。
参考答案:(1)s
(2)平面正三角形;sp2杂化
(3)1s22s22p63s23p63d104s1或 [Ar] 3d104s1
(4)Cu2++4NH3=[Cu(NH3)4]2+
(5)分子晶体
(6)配位键
(7)2:1
本题解析:
本题难度:一般
4、简答题 某化学学习兴趣小组,为了研究晶体的结构和性质,查阅了一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)-H2O相关资料:
一水合硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4)-H2O为蓝色正交晶体,常温下,它易溶于水,受热分解产生氨气和硫酸铜,易与空气中的二氧化碳、水反应生成铜的碱式盐,使晶体变成绿色粉末.
它的制备原理是利用硫酸铜溶液和氨水反应生成,其晶体的析出一般不宜用蒸发浓缩等常规方法.析出晶体方法:向硫酸铜溶液中加入浓氨水后,再加入浓乙醇溶液使晶体析出.
请回答下列问题:
(1)请写出制备硫酸四氨合铜(Ⅱ)的反应方程式:______.
(2)析出晶体不用蒸发浓缩方法的原因是______;其中乙醇的作用是______.
(3)硫酸四氨合铜属于配合物,晶体中Cu2+与NH3之间的键型为______,该化学键能够形成的原因是______.
(4)请你设计实验方案探究确定SO2-4为配合物外界.______.
参考答案:(1)根据题意知,硫酸铜和氨水反应生成硫酸四氨合铜(Ⅱ),反应方程式为CuSO4+4NH3+H2O=[Cu(NH3)4]SO4?H2O,故答案为:CuSO4+4NH3+H2O=[Cu(NH3)4]SO4?H2O;
(2)根据题意知[Cu(NH3)4]SO4?H2O受热分解,所以不能用蒸发浓缩法制取[Cu(NH3)4]SO4?H2O,[Cu(NH3)4]SO4?H2O在水中的溶解度大于在乙醇中的溶解度,所以向硫酸铜溶液中加入浓氨水后,再加入浓乙醇溶液能使晶体析出,
故答案为:[Cu(NH3)4]SO4?H2O受热分解,硫酸四氨合铜在乙醇中的溶解度远小于在水中的溶解度或减小水的极性;
(3)配合物中中心原子和配体之间存在配位键,所以硫酸四氨合铜配合物晶体中Cu2+与NH3之间的键型为配位键,中心原子是铜离子,提供空轨道,配体是氨分子提供孤电子对,从而形成配位键,
故答案为:配位键,NH3能提供孤对电子,Cu2+能接受孤对电子(或有空轨道);
(4)如果硫酸根离子为配合物的外界,则配合物溶于水后,能电离出自由移动的硫酸根离子,向溶液中加入硝酸钡溶液,如果溶液中有白色沉淀生成则证明硫酸根离子为配合物的外界,否则不是,
故答案为:取硫酸四氨合铜晶体溶于水配成溶液,向溶液中加入适量的Ba(NO3)2溶液,溶液中出现白色沉淀,说明溶液中有SO42-存在于外界.
本题解析:
本题难度:一般
5、填空题 (1)中国古代四大发明之一----黑火药,它的爆炸反应为:2KNO3+3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为___________。
②在生成物中,A的晶体类型为___________,含极性共价键的分子的中心原子轨道杂化类型为___________。
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为____________,Q2+的未成对电子数是___________。
(3)在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:
[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+
交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。将含0.0015mol [CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1NaOH溶液25.00mL,可知该配离子的化学式为___________。
参考答案:(1)①O>N>C>K;②离子晶体;sp;③1:1
(2)3d84s2;4
(3)[CrCl(H2O)5]2+
本题解析:
本题难度:困难