微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E均为可溶于水的固体,所得的溶液只有E溶液有颜色。取一定量的固体C放在试管中用酒精灯加热,固体的质量会减少。组成这五种物质的离子有(各物质所含的离子均不相同)
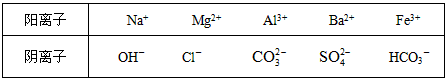
分别取它们的水溶液进行实验,结果如下:
①A溶液分别与其他四种溶液反应,均有沉淀;
②B溶液分别与其他四种溶液反应,也有沉淀;只是当B溶液加入到D溶液中时,先有沉淀继续加入B溶液时,沉淀会消失。
据此推断它们是A_________;B_________;C_________;D_________;E_________。
参考答案:A、Na2CO3;B、Ba(OH)2;C、Mg(HCO3)2;D、Al2(SO4)3;E、FeCl3
本题解析:
本题难度:一般
2、选择题 下列离子方程式书写正确的是
A.氢氧化铝溶于氢氧化钠溶液: Al(OH)?3+3OH- = AlO2- + 3H2O
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ═ Al(OH)3↓
C.用FeCl3溶液腐蚀铜电路板: 2Fe3++ Cu = 2Fe2++ Cu2+
D.铜片加入浓硝酸中:Cu+4H++2NO3-=Cu2++2H2O+2NO2↑
参考答案:CD
本题解析:A错误,电荷不守恒,正确的应该是Al(OH)3+OH- = AlO2- + 2H2O
B错误,氨水是弱碱弱电解质,在书写离子方程时不能拆写成离子形式。
C正确,铁离子被金属单质还原时,生成亚铁离子。
D正确
本题难度:一般
3、选择题 将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解,向混合物液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断不正确的是
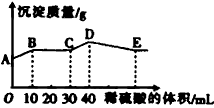
[? ]
A. AB段发生反应的的离子方程式为: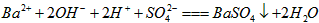
B. BC段发生反应的离子方程式为: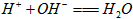
C. D点表示的沉淀的化学式为Al(OH)3、BaSO4
D. E点表示的溶液呈中性
参考答案:D
本题解析:
本题难度:一般
4、选择题 往100ml?1mol?L的Al2(SO4)3?溶液中加入100ml?4mol?L?Ba(OH)2溶液,最终得到沉淀的质量是
A.15.6g
B.69.9g
C.93.2g
D.85.5g
参考答案:B
本题解析:分析:向Al2(SO4)3?溶液中加入?Ba(OH)2溶液,先发生反应Al3++3OH-=Al(OH)3↓、Ba2++SO42-=BaSO4↓,若Al3+反应完毕,OH-还有剩余,还发生反应:Al(OH)3+OH-=AlO2-+2H2O,计算Al2(SO4)3?溶液中n(Al3+)、n(SO42-),Ba(OH)2溶液中n(Ba2+)、n(OH-),再结合离子方程式计算.
解答:Al2(SO4)3?溶液中:n(Al3+)=0.1L×1mol/L×2=0.2mol,n(SO42-)=0.1L×1mol/L×3=0.3mol,
Ba(OH)2溶液中:n(Ba2+)=0.1L×4mol/L×1=0.4mol,n(OH-)=0.1L×4mol/L×2=0.8mol,
由Ba2++SO42-=BaSO4↓可知,0.3molSO42-反应需要0.3molBa2+,Ba2+有剩余,0.3molSO42-完全反应,生成BaSO4为0.3mol;
由Al3++3OH-=Al(OH)3↓可知,0.2molAl3+完全反应生成Al(OH)3,需要0.6molOH-,剩余OH-为0.8mol-0.6mol=0.2mol,生成Al(OH)3为0.2mol,由Al(OH)3+OH-=AlO2-+2H2O可知,生成的0.2molAl(OH)3与剩余的0.2molOH-恰好反应,故最终固体为BaSO4为0.3mol,质量为0.3mol×233g/mol=69.9g;
故选B.
点评:本题考查离子方程式的有关计算,难度中等,清楚反应过程是解题的关键,注意过量计算判断是否有氢氧化铝生成,注意题目中硫酸根有剩余,沉淀的质量不是最大,硫酸根完全沉淀质量最大,铝离子恰好沉淀时,生成沉淀的物质的量最大.
本题难度:一般
5、填空题 (6分)(1) 碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
KIO3+?KI+?H2SO4=?K2SO4+?I2+?H2O
(2) 上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液(Na2SO3在有水参与时被氧化为Na2SO4),将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是?。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体;
以上设计中遗漏的操作及在上述步骤中的位置是?。
参考答案:25.(6分)
(1)? 1、5、3、3、3、3、
(2)?① I2+SO32-+H2O=2I-+SO42-+2H+
②在步骤b后,增加操作:将分液漏斗充分振荡后静置
本题解析:(1)碘酸钾中碘的化合价从+5价降低到0价,得到5个电子。碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,所以方程式为KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O.
(2)①单质碘能被亚硫酸钠还原生成碘离子,方程式为 I2+SO32-+H2O=2I-+SO42-+2H+。
②考查萃取实验操作,加入适量Na2SO3稀溶液后必需将分液漏斗充分振荡后静置,然后分液。
本题难度:一般