微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
?主族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0族
|
2
| ?
| ?
| ?
| ①
| ②
| ③
| ?
| ?
|
3
| ④
| ?
| ⑤
| ?
| ?
| ⑥
| ⑦
| ⑧
|
4
| ⑨
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1) 在这些元素中,化学性质最不活泼的是:??(填元素符号)。
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,④和⑨的最高价氧化物的水化物碱性强弱的比较:_____________(填相应化学式)。
(3) 最高价氧化是两性氧化物的元素是_____ ____(填元素符号);写出它的氧化物与氢氧化钠反应的离子方程式_____ _________ _________ _________ _________ ____。
(4)表示①和⑦生成的化合物的电子式??,
参考答案:(1)Ar?(2)HClO4? KOH>NaOH?
(3)Al? Al2O3+2NaOH =2NaAlO2+H2O?(4)略
本题解析:(1)稀有气体元素的最外层电子数已经达到稳定结构,所以选择最不活泼的,因此是Ar。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,所以是HClO4。金属性越强,最高价氧化物的水化物的碱性越强,钠的金属性弱于K的,所以碱性是KOH>NaOH。
(3)铝的氧化物氧化铝是两性氧化物,和氢氧化钠反应的方程式为Al2O3+2NaOH =2NaAlO2+H2O。
(4)①和⑦生成的化合物是四氯化碳,含有极性键的共价化合物,电子式为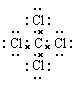 。
。
本题难度:简单
2、填空题 A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为?。
(2)B2 A和X的分子结合质子的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式?。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因?;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为?,Q为?(填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式?。
(6)已知工业合成X的反应方程式:D2 (g)+3B2 (g) 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有?。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有?。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
参考答案:
(1)第二周期ⅤA族?
(2)H3O++NH3=NH4++H2O
(3)Al3++3H2O Al(OH)3+3H+?
Al(OH)3+3H+?
(4)W? NaOH?,Q? NH4NO3 ?
(5)3CO2+2Al2H6=3CH4+2Al2O3?
(6)A
本题解析:根据题意得出A、B、C、D、E元素分别为O、H、Na、N、Al。(2)结合质子(H+)的能力不同,可以通过一种物质把另一种物质中结合的质子夺走来加以证明;(3)A、D、E三种元素形成的盐为Al(NO3)3,铝离子水解溶液呈酸性;(4)常温下0.1mol·L—1W的水溶液的pH为13,即氢氧根离子浓度为0.1mol·L—1,确定为一元强碱溶液,故为A为NaOH;Q的水溶液呈酸性且能和W反应放出气体,确定为NH4NO3;(6)A、平衡状态的标志,正逆反应速率相等,正确;B、温度不变,平衡常数不变,错误;C、反应为放热反应,升高温度平衡逆向移动,平衡常数变小,反应物转化率降低,错误;D、在达到平衡的过程中,随反应进行气体的物质的量变少,但总质量不变,摩尔质量变大,错误。
本题难度:困难
3、选择题 镭是周期表中第7周期第ⅡA族元素,下列关于镭的性质描述中不正确的是?
A.在化合物中呈+2价
B.镭比钙的金属性强
C.氢氧化物呈两性
D.碳酸盐难溶于水
参考答案:C
本题解析:第ⅡA族元素,包括:Be、Mg、Ca、Sr、Ba、Ra,同主族元素既有相似性,又有递变性;最高价=主族序数,故A正确;同主族,由上到下,原子的失电子能力逐渐增强,则元素的金属性逐渐增强,故B正确;同主族,由上到下,原子的失电子能力逐渐增强,则最高价氧化物对应水化物的碱性逐渐增强,Ca(OH)2、Ba(OH)2均为强碱,则Ra(OH)2为更强碱,故C错误;D项考查同族元素的相似性,碳酸钙、碳酸钡为难溶物,则碳酸镭也为难溶物,故G正确
本题难度:简单
4、选择题 运用元素周期律分析下面的推断,其中错误的是
A.砹(At)为有色固体,HAt不稳定
B.铊(T1)是铝的同族元素,原子核外有6个电子层,推测T1(OH)3是两性氢氧化物
C.已知锶Sr与镁同族且原子半径大于钙,硫酸锶(SrSO4)是难溶于水的白色固体
D.硒化氢(H2Se)比硫化氢稳定性差
参考答案:B
本题解析:A正确,卤素单质从上到下,颜色逐渐加深;由于氢化物的稳定性与元素的非金属性有关,非金属性越强氢化物越稳定;
B错,铝为第IIIA族元素,同主族元素从上到下元素的金属性增强,T1(OH)3不可能是两性氢氧化物;
C正确,对于第IIA族元素的硫酸盐来说,如硫酸镁溶于水,硫酸钙微溶于水,硫酸钡难溶于水,可推测硫酸锶(SrSO4)是难溶于水的白色固体;
D正确,硒与硫为同主族元素,且硒位于硫的下方,非金属性比硫弱,氢化物的稳定性比硫弱;
本题难度:一般
5、填空题 W、M、N、X、Y、Z是五种常见的短周期元素,其原子半径随原子序数变化如右图所示。已知W的一种核素的质量数为18,中子数为10;M和Ne原子的核外电子数相差1;N与X相邻;X的单质是一种常见的半导体材料;Y的最外层电子数是其最内层电子数的3倍;Z的非金属性在同周期主族元素中最大。

(1)元素X在周期表中的位置是_______________;元素Y的离子结构示意图为____________
(2)下列有关物质性质的比较中.正确的是________________
A.M、X、Z形成的单质熔沸点 M>X>Z
B.氢化物的热稳定性:W>X
C.X分别与W和Z形成的化合物中化学键类型,晶体类型均相同
D.Z元素含氧酸的酸性一定强于Y元素的含氧酸