微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将等体积的0.1 mol·L-1 KHSO4溶液逐滴加入0.1 mol·L-1的Na2SO3溶液中,所得溶液能使紫色石蕊试液变红,则下列各离子浓度关系中不正确的是
A.c(SO)>c(SO)>c(H+)>c(OH-)
B.c(Na+)>c(K+)>c(H+)>c(OH-)
C.c(Na+)=c(SO)+c(H2SO3)+c(HSO)+c(SO)来源:91 考试网
D.c(Na+)+c(K+)+c(H+)=2c(SO)+c(HSO)+c(OH-) +2c(SO)
参考答案:A
本题解析:H++SO32-=HSO3-,恰好完全反应,此时是0.1molSO42-和0.1molHSO3-的溶液,因为所得溶液能使紫色石蕊试液变红,溶液显酸性,HSO3-的电离程度大于水解程度,
A.错误,应为:c(SO)>c(H+)>c(SO)>c(OH-)
B 正确,由题意可知,钠离子浓度为0。2 mol·L-1,价钾离子浓度为0.1 mol·L-1,溶液显酸性,氢离子浓度大于氢氧根离子浓度
C正确,遵循物料守恒c(SO)+c(H2SO3)+c(HSO)="0.1" mol·L-1,c(SO)="0.1" mol·L-1,
c(Na+)="0.2" mol·L-1
D 正确,遵循质子守恒。
本题难度:一般
2、选择题 在盐类的水解过程中,下列各种情况必定发生的是
A.盐的电离平衡被破坏
B.水的电离平衡被破坏
C.25℃,溶液的pH不是7
D.溶液温度升高
参考答案:B
本题解析:盐的水解本质上是弱酸或弱碱的离子与水电离的氢离子或氢氧根离子结合,打破水的电离平衡,故答案为B。
本题难度:简单
3、选择题 已知在常温下测得浓度均为0.1 mol·L-1的下列三种溶液的pH:
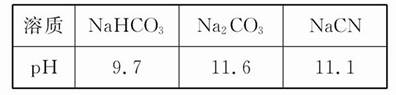
下列说法中正确的是(? )
A.阳离子的物质的量浓度之和:Na2CO3>NaCN>NaHCO3
B.相同条件下的酸性:H2CO3<HCN
C.三种溶液中均存在电离平衡和水解平衡
D.升高Na2CO3溶液的温度,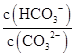 减小
减小
参考答案:C
本题解析:阳离子均为Na+和H+,Na2CO3溶液中Na+浓度是其他两种溶液的两倍,阳离子浓度最大,NaCN溶液和NaHCO3溶液中Na+浓度相等,NaCN溶液中H+浓度小于NaHCO3溶液,故阳离子浓度大小顺序为Na2CO3>NaHCO3>NaCN,A项错误;HCO3-的水解能力小于CN-,故酸性:H2CO3>HCN,B项错误;升高Na2CO3溶液的温度,促进其水解,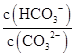 增大,D项错误。
增大,D项错误。
本题难度:一般
4、选择题 已知HF的电离程度大于等浓度的CH3COOH的电离程度,则在相同条件下,同浓度等体积的NaF、CH3COONa溶液中,离子总数()
A.前者多
B.后者多
C.一样多
D.无法确定
参考答案:A
本题解析:NaF和CH3COONa全部电离,Na+数相等。
F-+H2O HF+OH-CH3COO-+H2O
HF+OH-CH3COO-+H2O CH3COOH+OH-
CH3COOH+OH-
HF比CH3COOH电离程度大。
对于NaF溶液,离子总数n1=n(Na+)+n1(OH-)+n1(H+)+n(F-)
同理,CH3COONa溶液离子总数n2=n(Na+)+n2(OH-)+n2(H+)+n(CH3COO-)
以NaF为例,n(F-)=n(Na+)-〔n1(OH-)-n1(H+)〕
其中,n1(OH-)-n1(H+)=n(HF)
由此可得:n1=n(Na+)+n(Na+)-〔n1(OH-)-n1(H+)〕+n1(OH-)+n1(H+)
=2n(Na+)+2n1(H+)
同理,n2=2n(Na+)+2n2(H+)
由于两溶液n(Na+)相等,且CH3COONa水解程度大,n2(H+)<n1(H+)。故有:
n1-n2=2n1(H+)-2n2(H+)>0。
即NaF溶液的离子总数多。由此也可以得出一个推论:对于弱酸强碱盐或弱碱强酸盐,水解后溶液中组成盐的离子总数减少,水解程度越大,减少得越多。进一步还可以推出:弱酸弱碱盐水解后组成盐的离子总数将会大大减少。
应选A项。
本题难度:简单
5、选择题 下列溶液常温下跟镁反应生成氢气的是……( )
A.NaOH
B.NH4Cl
C.HNO3
D.Na2CO3
参考答案:B
本题解析:A、不反应。
B、在NH4Cl溶液中存在:NH4++H2O NH3·H2O+H+
NH3·H2O+H+
Mg+2H+=Mg2++H2↑
C、能反应但不产生氢气。
D、不能反应。
本题难度:一般