微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学反应过程中发生物质变化时,常常伴有能量的变化。这种能量的变化常以热能的形式表现出来,叫反应热。由于反应的情况不同,反应热可以分为多种,如标准燃烧热和中和热等等。下列△H表示标准燃烧热的是
A.2H2(g)+O2(g)===2H2O(l);△H1
B.C(s)+1/2O2(g)===CO(g);△H2
C.4NH3(g)+5O2(g)===4NO(g)+6H2O(l);△H3
D.C(s)+O2(g)===CO2(g);△H4
参考答案:D
本题解析:略
本题难度:简单
2、填空题 某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW=?。在此温度下,将 pH = a的 NaOH 溶液 Va L 与 pH = b的 H2SO4溶液 Vb L 混合。
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb=?;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb=?;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb=?。
参考答案:(12分)
KW=10-13
(1)1:10?(2)10:1?(3)1:9
本题解析:解:0,01mol/l的NaOH溶液中C(OH-)=0.01mol/L=10-2mol/L,
pH为11的氢氧化钠溶液中C(H+)=10-11mol/L。
该温度下水的离子积常数Kw=C(H+)*C(OH-)= 10-11mol/L*10-2mol/L=10-13(mol/L)2。
①pH=12的NaOH溶液中C(H+)=10-12mol/L
则氢氧化钠溶液中C(OH-)=Kw/C(H+)=10-13(mol/L)2/10-12mol/L=10-1mol/L
pH=2的硫酸中C(H+)=10-2mol/L,
若所得混合液为中性,则C(H+)*Vb=C(OH-)*Va,
Va:Vb=10-2:10-1=10-2:10-1=1:10。
②所得混合液为中性,则C(H+)*Vb=C(OH-)*Va;且 a+ b= 12,
Va:Vb=C(H+):C(OH-)=C(H+):[Kw/C(H+)]=10-b:10-13+a=1013-a-b=10:1。
③pH=12氢氧化钠溶液中C(OH-)=10-1mol/L,
pH=2的硫酸中C(H+)=10-2mol/L,
pH=10的溶液中C(OH-)=10-13(mol/L)2/10-10mol/L=10-3mol/L,
若所得混合液的pH=10,则说明碱过量,
C(OH-)*Va-C(H+)*Vb=10-1mol/L*Va-10-2mol/L*Vb=(Va+Vb)*10-3mol/L,
解得:Va:Vb=1:9。
点评:
1、强酸、强碱溶液的pH
强酸直接由酸的浓度求出c(H+),强碱先由碱的浓度求出c(OH-),再根据水的离子积换算出c(H+),然后用公式Kw = c(H+)·c(OH—)=1×10-14?pH=" -" lg c(H+)求解
2、两强酸混合抓住氢离子进行计算? 2、两强碱混合抓住OH-进行计算,再转化为H+
c (H+) = 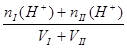 ?c (OH-])=
?c (OH-])= 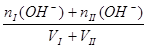
经验规律:(1)两强酸等体积混合?混合后的pH=小的+0.3
(2)两强碱等体积混合?混合后的pH=大的—0.3
3、强酸、强碱混合,酸过量抓住氢离子进行计算、碱过量抓住氢氧根离子进行计算。
(3)酸I+碱II
完全中和:c(H+)=? c(OH-) =? 1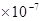 mol/L?
mol/L?
酸过量: c(H+)= 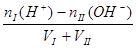 ?碱过量:c(OH-)=
?碱过量:c(OH-)= 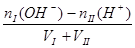
本题难度:一般
3、选择题 某兴趣小组经实验测定,在1×105 Pa,298 K条件下,1 mol氢气完全燃烧生成水蒸气放出242 kJ热量,下列热化学方程式正确的是? ( )
A.H2O(g)=H2(g)+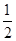 O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+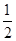 O2(g)=H2O(g) ΔH=+242 kJ·mol-1
O2(g)=H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1
参考答案:A
本题解析:1 mol H2完全燃烧生成水蒸气时放出的热量为242 kJ,故C、D选项中热量值应为负值,不正确;B选项H2O的状态应为气态,不正确;H2O的分解反应与化合反应方向相反,吸热与放热的数值相等。
本题难度:一般
4、填空题 (14分)用中和滴定法测定某烧碱样品的纯度。有以下步骤:
(1)配制待测液:用5.00 g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1 000 mL溶液。除烧杯外,还需要的玻璃仪器有___________、?、?_。
(2)滴定:
①盛装0.1000 mol·L-1盐酸标准液应该使用_______式滴定管。②滴定时双眼应?。
③有关数据记录如下:
测定序号
| 待测溶液的体积/mL
| 所耗盐酸标准液的体积/mL
|
滴定前
| 滴定后
|
1
| 20.00
| 0.50
| 20.78
|
2
| 20.00
| 1.20
| 21.32
|
(3)计算纯度:烧碱样品的纯度是_________________。
(4)误差讨论(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果___________;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果___________;
③读数时,滴定前仰视,滴定后俯视,则会使测定结果___________。
参考答案:(1)1 000 mL容量瓶、玻璃棒、胶头滴管?
(2)①酸?②注视锥形瓶中溶液颜色的变化?
(3)80.8%?(4) ①无影响? ②偏高? ③偏低
本题解析:(1)在配制溶液时,除烧杯外,还需要的玻璃仪器有1000 mL容量瓶、玻璃棒、胶头滴管。
(2)盐酸标准溶液应该使用酸式滴定管,滴定时眼睛注视锥形瓶中溶液颜色的变化。
(3)滴定过程中使用盐酸的体积为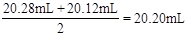 ,所以烧碱样品的纯度为
,所以烧碱样品的纯度为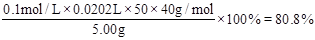 。
。
(4)根据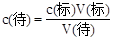 ,用蒸馏水冲洗锥形瓶,不影响标准液的用量,所以无影响;在滴定过程中不慎将数滴酸液滴在锥形瓶外,标准液的体积比正常值大,所以偏高;读数时,滴定前仰视,滴定后俯视,标准液的体积比正常值小,所以偏低。
,用蒸馏水冲洗锥形瓶,不影响标准液的用量,所以无影响;在滴定过程中不慎将数滴酸液滴在锥形瓶外,标准液的体积比正常值大,所以偏高;读数时,滴定前仰视,滴定后俯视,标准液的体积比正常值小,所以偏低。
点评:本题非常基础,主要考查酸碱中和滴定的基本操作和误差分析。
本题难度:一般
5、选择题 25℃时,PH和体积均相等的氨水和烧碱溶液中c(NH4+)与c(Na+)关系正确的是
A.c(NH4+)>c(Na+)
B.c(NH4+)=c(Na+)
C.c(NH4+)<c(Na+)
D.无法判断
参考答案:B
本题解析:两溶液中分别存在电荷守恒:c(NH4+)+c(H+)=c(OH—)、c(Na+)+c(H+)=c(OH—),由于两溶液的pH相同,即c(H+)、c(OH—)均相同,必然可得出c(NH4+)=c(Na+)
答案为B
本题难度:一般