|
高考化学知识点总结《离子共存》答题技巧(2017年最新版)(六)
2017-08-22 14:20:07
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组离子因发生水解反应而不能大量共存的是
A.Ba2+、Cl-、Na+、SO42-
B.AlO2-、K+、HCO3-、Cl-
C.OH-、Fe3+、NO3-、SO42-
D.Al3+、Na+、HCO3-、Cl-
参考答案:D
本题解析:A项Ba2+和SO42-因生成沉淀不能大量共存,B项AlO2-和HCO3-因为发生强酸制弱酸反应不能大量共存,C项OH-和Fe3+因为生成沉淀不能大量共存,D项Al3+和HCO3-因为发生双水解反应不能大量共存。答案选D。
点评:离子不能大量共存的一般情况是:(1)能发生复分解反应的离子之间(即生成沉淀,气体,水、弱酸、弱碱等难电离物质);(2)能生成难溶物的离子之间(如:Ca2+和 SO42-;Ag+和 SO42-);(3)能完全水解的离子之间,如多元弱酸和弱碱盐的阴、阳离子(如:Al3+, Fe3+与 CO32-、HCO3-、AlO2-、ClO-,S2-等);(4)能发生氧化还原反应的离子之间(如:Fe 、H+、NO3-;S2-、ClO-;S2-、 Fe3+等);(5)能发生络合反应的离子之间(如 Fe3+和 SCN-);解决离子共存问题时还应该注意题目所隐含的条件,题目所隐含的条件一般有(1)溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;(2)溶液的颜色,如无色时可排除 Cu2+、 Fe2+、Fe3+、MnO4-等有色离子的存在;(3)溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;(4)是“可能”共存,还是“一定”共存等。
本题难度:一般
2、选择题 下列解释实验事实的离子方程式正确的是?(?)
A.漂白粉中滴加稀盐酸增强漂白性: Ca(ClO)2+2H+=Ca2++2HClO
B.向明矾溶液中滴入石蕊试液,溶液变红:Al3++3H2O=Al(OH)3↓+3H+
C.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑
D.双氧水滴加到酸性高锰酸钾溶液中,紫色褪去、产生大量气泡:
| 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O
参考答案:D
本题解析:A不正确,次氯酸钙应该用离子符号表示;铝离子水解是可逆反应,生成的是氢氧化铝胶体,B不正确;C中没有配平,应该是2Na2O2+2H2O=4Na++4OH-+O2↑,所以正确的答案选D。
点评:该题是高考中的高频题,属于中等难度的试题,侧重对学生能力的培养和训练。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:一般
3、填空题 (12分)(1)某研究性学习小组在实验室中配制1 mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________。
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60 mL 的稀硫酸标准溶液,配制时应选用100 mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、配制溶液时,若在最后一次读数时俯视读数,则导致最后实验结果偏大。
F、中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大。
(2)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH=?;写出该酸(HA)与NaOH溶液反应的离子方程式:?;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是:?;
③0.2 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)=?mol·L-1。(溶液体积变化忽略不计)
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= ?。
①该温度下(t℃),将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH=?。
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是:?。
参考答案:(12分)(1)ABD (2分)?
(2) ①3? HA+OH ===A ===A +H2O? ②c(A +H2O? ②c(A )>c(Na+)>c(H+)>c(OH )>c(Na+)>c(H+)>c(OH )? ③0.05?各1分 )? ③0.05?各1分
(3)10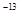 ?(2分)? ①12 (2分)? ②pHa+pHb=12(2分) ?(2分)? ①12 (2分)? ②pHa+pHb=12(2分)
本题解析:(1)容量瓶中含有少量蒸馏水,不会影响溶质和溶剂的质量,所以不影响实验结果,C不正确;配制溶液时,若在最后一次读数时俯视读数,则浓硫酸的体积偏小,导致最后实验结果偏低,D不正确;中和滴定时,若在最后一次读数时俯视读数,则消耗硫酸的体积减小,导致最后实验结果偏小,F不正确,其余选项都是正确的,答案选ABD。
(2) ①根据水的离子积常数可知,如果c(OH-) / c(H+)=1×10-8,则溶液中OH-离子浓度是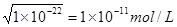 。则氢离子浓度是0.001mol/L,所以pH=3,这说明HA是弱酸,所以和氢氧化钠反应的离子方程式是HA+OH 。则氢离子浓度是0.001mol/L,所以pH=3,这说明HA是弱酸,所以和氢氧化钠反应的离子方程式是HA+OH ===A ===A +H2O。? +H2O。?
②由于HA是弱酸,所以pH=3的HA溶液的浓度大于0.001mol/L,则在和氢氧化钠的反应中HA是过量的,因此反应后溶液显酸性,则离子浓度大小顺序是c(A )>c(Na+)>c(H+)>c(OH )>c(Na+)>c(H+)>c(OH ) 。 ) 。
③0.2 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合后,酸是过量的,所以根据电荷守恒定律和物料守恒可知,c(Na+)+c(H+)=c(OH )+c(A )+c(A )、2c(Na+)=c(HA)+c(A )、2c(Na+)=c(HA)+c(A )。则c(H+)+c(HA)-c(OH-)=c(Na+)=0.05mol/L。 )。则c(H+)+c(HA)-c(OH-)=c(Na+)=0.05mol/L。
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则0.01=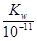 ,解得该温度下水的离子积常数Kw=10 ,解得该温度下水的离子积常数Kw=10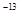 。 。
①硫酸和氢氧化钠的物质的量是0.01mol和0.04mol,则氢氧化钠是过量的,所以溶液中OH-浓度是(0.04mol-0.02mol)÷0.2L=0.1mol/L,则溶液中氢离子浓度是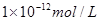 ,即pH=12。 ,即pH=12。
②1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则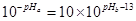 ,解得pHa+pHb=12。 ,解得pHa+pHb=12。
点评:在比较溶液中离子浓度大小时,应该充分利用好电荷守恒定律、质子守恒以及物料守恒等关系式。其次在利用水的离子积常数进行有关计算时,必需注意水的离子积常数与温度有关系,由于电离是吸热的,所以水的离子积常数随温度的升高而增大,只有在常温常压下pH=7的溶液才是显酸性的。
本题难度:一般
4、选择题
A.NH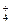 、Mg2+、SO 、Mg2+、SO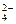 、Cl- 、Cl-
B.Ba2+、K+、OH-、NO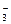
C.Al3+、Cu2+、SO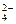 、Cl- 、Cl-
D.Na+、Ca2+、Cl-、AlO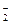
参考答案:A
本题解析:解此题时要注意审题。一是注意pH=1,溶液呈酸性;二是注意溶液为无色。选项B中的OH-与选项D中的AlO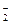 都不能在酸性条件下存在;选项C中的Cu2+为蓝色的。 都不能在酸性条件下存在;选项C中的Cu2+为蓝色的。
本题难度:一般
5、填空题 (9分)化合物A、B、C、D、E分别由H+、Na+、Al3+、Cu2+四种阳离子和CO32-、Br-、SiO32-、SO42-四种阴离子组成。已知①A、B、C三种溶液pH<7,D、E溶液pH>7②A、C的阴离子相同,D、E的阳离子相同?③用石墨电极电解A的溶液,阳极有无色气体产生,阴极有红色物质生成?④C溶液与D溶液反应能生成一种白色沉淀和一种气体,且此沉淀可溶于B的溶液,此气体通入E的溶液中可产生另一种白色沉淀。
请根据以上事实填空:
⑴写出B、C、E的化学式:B___________、C___________、E____________。
⑵D溶液的pH>7,原因是:(结合离子方程式说明)__________________________________。
⑶写出C溶液与D溶液发生反应的离子方程式:_______________________。
⑷若用石墨电极电解400mL 1.0 mo1·L—1 A的溶液,当阳极有2.24 L气体(标准状况)产生时,溶液的pH=_______________(设溶液的体积不变)。
参考答案:(1)HBr? Al2(SO4)3? Na2SiO3?(3分)
(2)CO32-+H2O  HCO3-+OH-,使得C(OH-)>C(H+) HCO3-+OH-,使得C(OH-)>C(H+)
⑶2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑?⑷ 0
本题解析:根据③可知,A应该是硫酸铜。根据④可知,白色沉淀是氢氧化铝,所以B是氢氧化钠。气体是CO2,则CO2和E反应生成的白色沉淀是硅酸,所以E是硅酸钠。又因为A、C的阴离子相同,D、E的阳离子相同,所以D是碳酸钠,C是硫酸铝,则B是HBr。
(1)略
(2)碳酸钠是强碱弱酸盐,CO32-水解,方程式为CO32-+H2O  HCO3-+OH-,使得c(OH-)>c(H+),所以溶液显碱性。 HCO3-+OH-,使得c(OH-)>c(H+),所以溶液显碱性。
(3)铝离子水解显酸性,和CO32-水解相互促进,方程式为2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑。
(4)阳极是OH-放电,生成氧气,物质的量是0.1mol。根据总方程式2CuSO4+2H2O 2Cu+2H2SO4+O2↑可知,同时产生的氢离子的物质的量是0.4mol,其浓度是1.0mol/L,所以pH=0。 2Cu+2H2SO4+O2↑可知,同时产生的氢离子的物质的量是0.4mol,其浓度是1.0mol/L,所以pH=0。
本题难度:一般
|