微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 I.丙烯酸的结构简式是:CH2? CHCOOH。试写出它与下列物质反应的化学方程式。

(1)氢氧化钠溶液________________________________________。
(2)溴水________________________________________。
(3)乙醇________________________________________。
II.4.6g某有机物完全燃烧,得到8.8g二氧化碳和5.4g水.此有机物的蒸气对氢气的相对密度为23(相同状况下).该有机物与金属钠反应放出氢气.其分子式为?,结构简式为?。
参考答案:I.(1)CH2=CHCOOH+NaOH? ?CH2=CHCOONa+H2O?
?CH2=CHCOONa+H2O?
(2)CH2=CHCOOH+Br2 ? CH2BrCHBrCOOH
? CH2BrCHBrCOOH
(3)CH2=CHCOOH+C2H5OH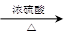 CH2=CHCOOC2H5+H2O
CH2=CHCOOC2H5+H2O
II.? C2H6O? C2H5OH或CH3CH2OH
本题解析:Ⅰ 根据有机物的结构简式准确识别官能团,根据官能团的性质作答。CH2=CHCOOH含有羧基,能与醇发生酯化反应、与碱发生中和反应;含有碳碳双键,能与溴水发生加成反应。化学方程式为:
(1)CH2=CHCOOH+NaOH? ?CH2=CHCOONa+H2O?
?CH2=CHCOONa+H2O?
(2)CH2=CHCOOH+Br2 ? CH2BrCHBrCOOH
? CH2BrCHBrCOOH
(3)CH2=CHCOOH+C2H5OH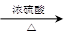 CH2=CHCOOC2H5+H2O
CH2=CHCOOC2H5+H2O
II.根据题意知,有机物的蒸气对氢气的相对密度为23(相同状况下),该有机物的相对分子质量为46,4.6g某有机物完全燃烧,得到8.8g二氧化碳和5.4g水,根据原子守恒知,1mol有机物中含有2molC和6molH,结合相对分子质量知,其分子式为C2H6O;该有机物与金属钠反应放出氢气,应为乙醇,结构简式为C2H5OH或CH3CH2OH。
本题难度:一般
2、选择题 下列对有机物结构或性质的描述中正确的是( )。
A.根据甲烷分子中四个键的键角相等,就可推知甲烷为正四面体结构
B.分子式为C4H8的烯烃与氢气加成反应后得到的烷烃有3种
C.乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O
D.苯中无碳碳双键, 化学性质稳定,不能发生氧化反应
参考答案:C
本题解析:A、四个键的键角相等,不一定是正四面体结构,正方形结构的键角也相同,错误;B、分子式为C4H8的烯烃与氢气加成反应后得到的烷烃有2种,正丁烷和异丁烷,错误;C、C2H6和C3H6分钟内都含6个H原子,所以1mol乙烷和丙烯完全燃烧生成3 mol H2O,正确;D、苯与氧气燃烧,属于氧化反应,错误。
本题难度:一般
3、选择题 晚会上,常见到观众手持常被称为“魔棒”的荧光棒给晚会助兴,“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式为:
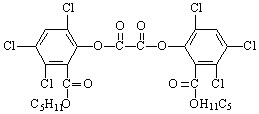
下列有关说法正确的是
A.草酸二酯属于高分子化合物
B.草酸二酯属于芳香族化合物
C.1mol草酸二酯与氢氧化钠稀溶液反应(苯环上卤素不水解),最多消耗4molNaOH
D.1mol草酸二酯与氢气完全反应,需要氢气10mol
参考答案:B
本题解析:A不正确,根据结构简式可知,不是高分子化合物。分子中含有苯环,属于芳香族化合物,B正确。分子中含有4个酯基,但水解后又产生2个酚羟基,所以最多消耗6molNaOH,C不正确。酯基不能发生加成反应,所以需要氢气6mol,D不正确,答案选B。
本题难度:一般
4、实验题 实验室制备乙酸乙酯的反应和实验装置如下:
CH3COOH + C2H5OH  CH3COOC2H5 + H2O
CH3COOC2H5 + H2O
投料? 1?:? 1?产率? 65%
1?:? 10? 97%
(在120 ℃下测定)

已知:相关物理性质(常温常压)
?
| 密度g/mL
| 熔点/℃
| 沸点/℃
| 水溶性
|
乙醇
| 0.79
| -114
| 78
| 溶
|
乙酸
| 1.049
| 16.2
| ~117
| 溶
|
乙酸乙酯
| 0.902
| ?84
| ~76.5
| 不溶
|
?
合成反应:
在三颈瓶中加入乙醇5 mL,硫酸5 mL,2小片碎瓷片。漏斗加入乙酸14.3 mL ,乙醇20 mL。冷凝管中通入冷却水后,开始缓慢加热,控制滴加速度等于蒸馏速度,反应温度不超过120 ℃。
分离提纯:
将反应粗产物倒入分液漏斗中,依次用少量饱和的Na2CO3溶液、饱和NaCl溶液、饱和CaCl2溶液洗涤,分离后加入无水碳酸钾,静置一段时间后弃去碳酸钾。最终通过蒸馏得到纯净的乙酸乙酯。
回答下列问题:
(1)酯化反应的机制
用乙醇羟基氧示踪
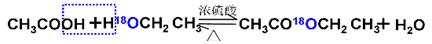
用醋酸羟基氧示踪
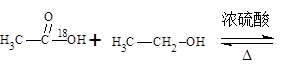
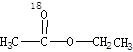
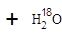
含氧18水占到总水量的一半,酯也一样。这个实验推翻了酯化反应为简单的取代反应。请你设想酯化反应的机制?。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数K=?。
为了使正反应有利,通常采用的手段是:
①使原料之一过量。谁过量 ?
无水乙醇3600元/吨,冰醋酸2900元/吨。每摩乙醇?元,每摩冰醋酸?元。
②不断移走产物[例如除水,乙酸乙酯、乙醇、水可形成三元恒沸物(沸点:70.2 ℃),乙酸不能形成三元恒沸物]。综上所述选择?过量。
(3)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加?B.冷却后补加? C.不需补加 ?D.重新配料
(4)浓硫酸与乙醇如何混合??。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是??。
(6)蒸出的粗乙酸乙酯中主要有哪些杂质??。
饱和的Na2CO3溶液洗涤除去乙酸。如何判断是否除净??。
用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,为什么不用水??。
用饱和CaCl2溶液直接洗涤起什么作用:?。
参考答案:(1)先加成反应生成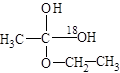 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成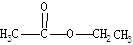 和
和 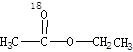 ?(2分)
?(2分)
(2)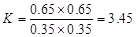 (2分)?① 0.1656 (1分) 0.174 (1分)
(2分)?① 0.1656 (1分) 0.174 (1分)
②乙醇 (1分)
(3)防暴沸?(1分)?B (1分)
(4)先加入乙醇后加入硫酸,边振荡加滴加。(1分)
(5)保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。(1分)
(6)乙醚、乙酸、乙醇和水(1分)? pH试纸检验不显酸性(1分)
减少乙酸乙酯溶解(1分)?除去少量的乙醇(1分)
本题解析:(1)用醋酸羟基氧示踪
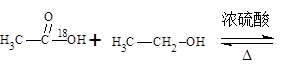
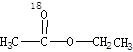
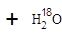
将C—O单键变C=O的是消去反应。而含氧18水占到总水量的一半,酯也一样。说明是同一个碳原子上存在—OH和—18OH两个羟基。酯化反应的机制为先加成反应生成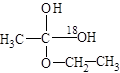 后消去失水,失水有两种可能分别生成
后消去失水,失水有两种可能分别生成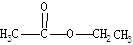 和
和 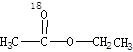 。
。
(2)酯化反应是一个可逆的反应,120 ℃时,平衡常数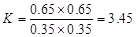 。
。
①因无水乙醇3600元/吨,每摩乙醇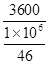 ?=0.1656元;
?=0.1656元;
冰醋酸2900元/吨。每摩冰醋酸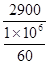 =0.174元。
=0.174元。
使原料之一过量,应为价格低廉的乙醇。
(3)加入碎瓷片的作用是防暴沸;如果加热一段时间后发现忘记加瓷片,反应液的温度过高,应该采取的正确操作是冷却后补加。
(4)浓硫酸与乙醇混合属于浓硫酸的稀释,先加入乙醇后加入硫酸,边振荡加滴加。
(5)控制滴加乙酸和乙醇混和液的速度等于蒸馏速度目的是保证乙醇量是乙酸量10倍以上,提高乙酸的转化率。
(6)根据乙酸、乙醇之间和乙醇本身的反应,蒸出的粗乙酸乙酯中主要含有乙醚、乙酸、乙醇和水。
饱和的Na2CO3溶液洗涤除去乙酸。pH试纸检验不显酸性判断已经除净乙酸。用饱和NaCl溶液洗涤除去残留的Na2CO3溶液,是微粒减少乙酸乙酯溶解。用饱和CaCl2溶液直接洗涤可以除去少量的乙醇。
本题难度:一般
5、选择题 下列各组物质互为同分异构体的是
A.O2和O3
B.CH3CH2CH2CH3和CH(CH3)3
C.12C和13C
D.CH3和CH3CH3
参考答案:B
本题解析:分子式相同,而结构不同的化合物互为同分异构体,选项B正确。A中互为同素异形体,C中互为同位素,D中互为同系物,答案选B。
本题难度:一般