微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以下是一些原子的2p能级和3d能级中电子排布的情况。其中违反了洪特规则的是
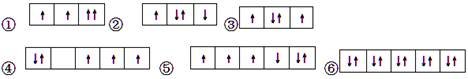
A.①
B.①③
C.②④⑤
D.③④⑤
参考答案:C
本题解析:当电子排布在同一个能级的不同轨道时,基态原子中的电子总是单独优先占据一个轨道,而且自旋状态相同,称为洪特规则,据此可以判断。①同一轨道自旋方向相同,违反泡利不相容原理;②不同轨道的单电子自旋方向不同,违反了洪特规则;③符合洪特规则;④应优先占据不同的轨道,每个轨道有1个电子,违反了洪特规则;⑤不同轨道的单电子自旋方向不同,违反了洪特规则;⑥符合洪特规则,所以其中违反了洪特规则的是②④⑤,答案选C。
本题难度:一般
2、选择题 下列有关分子、原子的叙述错误的是(?)
A.在化学反应中,分子可以再分,而原子不能再分
B.分子是保持物质化学性质的一种粒子
C.分子、原子都是构成物质的粒子
D.原子是不能再分的一种粒子
参考答案:D
本题解析:原子是化学变化中的最小粒子,即在化学反应中,分子可以再分,而原子不能再分;但是单独的一个原子还可分为原子核和核外电子,故D选项不正确。
本题难度:简单
3、简答题 、I.德国和美国科学家首先制出由20个碳原子组成的空心笼状分子C20,该笼状结构是由许多正五边形构成如图。
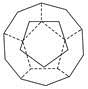
①C20分子中每个碳原子只跟相邻的3个碳原子形成化学键;
②多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数+棱边数=2,
请回答: C20分子共有________个正五边形,共有________条棱边。
II.A、B、C是短周期非金属元素,核电荷数依次增大。A原子外围电子排布为ns2np2,C是地壳中含量最多的元素。D元素的核电荷数为29。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)分子(AB)2中键与键之间的夹角为180°,并有对称性,每个原子最外层电子数均满足八电子,其结构式为________,1 mol该分子中含有π键的数目为________。该分子中碳原子的杂化轨道类型是__________________,该分子属于________分子(填“极性”或“非极性”)。
(3)基态D原子的电子排布式为________________。
参考答案:I.12 30
II.? (1)C<O<N
(2) 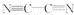 ? 4NA(或2.408×1024) sp 非极性
? 4NA(或2.408×1024) sp 非极性
(3)1s22s22p63s23p63d104s1
本题解析:I.顶点数为20、棱数为20×3÷2=30、面数=30+2-20=12。
II.由题意可知,A、B、C、D四种元素分别是C、N、O、Cu,(1)注意,第一电离能N>O。
(2)(AB)2中键与键之间的夹角为180°,说明该分子为对称直线型非极性分子。(3)Cu的前三层是全充满状态,前三层占有28个电子。
本题难度:一般
4、填空题 (10分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ??,B?,C?,D?,E?
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:
?。
(3)写出A、B两元素相互反应的化学方程式:
??。
(4)比较C 、D的最高价氧化物的水化物的酸性:(用化学式表示)
?。
参考答案:(1)A? Na,? B Al,? C? Si,? D P ,? E Cl
(2)?。
(3)? Al(OH)3+NaOH=NaAlO2+2H2O。
(4)? H3PO4>H2SiO3。
本题解析:
 已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,这样可以知道它们之中有一个具有两性,即Al?
已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,这样可以知道它们之中有一个具有两性,即Al?
根据是原子序数依次增大的短周期元素?
A 就是Na?
E就是Cl
B就为Al
C元素的最外层电子数比次外层电子数少4?即Si
D元素原子次外层电子数比最外层电子数多3?即P
(1) 见上
(2) 
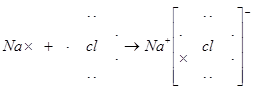
(3) Al(OH)3+NaOH=NaAlO2+2H2O
(4) 根据元素周期律?同周期元素的非金属性逐渐增强?酸性增强
 ? H3PO4>H2SiO3
? H3PO4>H2SiO3
本题难度:一般
5、选择题 下列叙述正确的是
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.ⅠA族元素的金属性比ⅡA族元素的金属性强
C.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高
D.第三周期元素的离子半径从左到右逐渐减小
参考答案:C
本题解析:略
本题难度:一般