|
高中化学知识点大全《未知》高频试题强化练习(2017年最新版)(八)
2017-08-22 14:31:19
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)湿法炼锌为现代炼锌的主要方法,下列是以硫化锌精矿为原料制备单质锌的工业流程。

(1)烟气不能直接排放,可用于制取一种常见的强酸,该强酸为__________。
(2)浸出液以硫酸锌为主,还含有Fe3+、Fe2+、A13+、Cu2+、Cd2+、C1一等杂质,会影响锌的电解,必须除去。净化过程如下:
①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,离子方程式为______________________。
②将浸出液的pH调节为5.5左右,使Fe3+、A13+形成沉淀而除去,可选用的试剂为_____(填字母)
A.NaOH
B.NH3·H2 O
C.ZnO
D.H2 SO4
| ③用Zn除去Cu2+和Cd2+
④用Ag2SO4除去Cl一,发生的反应为Ag2SO4+2Cl一 2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。 2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
(3)控制一定条件,用惰性电极电解硫酸锌溶液制取锌,锌在____极析出,阳极反应式为__________。
参考答案:(1)硫酸 (或H2SO4) (1分)(2)①2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O(2分)
②C(2分) ④1.5×1015(2分)
(3)阴(1分) 2H2O - 4e-=O2↑+4H +(写 4OH-- 4e-=O2↑+ 2H2O 也可)(2分)
本题解析:(1)ZnS燃烧时S元素转化为SO2,SO2是大气污染物,因此烟气不能直接排放。SO2可以被氧化最终转化为硫酸。
(2)①双氧水具有氧化性,则在酸性条件下,H2O2将Fe2+氧化成Fe3+的离子方程式为2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O。
②由于不能引入新的杂质,所以只能选择氧化锌调节溶液的pH,答案选C。
④根据反应Ag2SO4+2Cl一 2AgCl+ SO42-可知室温下该反应的平衡常数 2AgCl+ SO42-可知室温下该反应的平衡常数
K=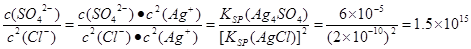 。 。
(3)电解池中阳极失去电子,发生氧化反应,阴极得到电子发生还原反应,则锌离子在阴极放电析出锌。阳极是溶液中的氢氧根离子放电,则阳极反应式为4OH-- 4e-=O2↑+ 2H2O。
考点:考查物质制备工艺流程图的分析与应用
本题难度:困难
2、填空题 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应: KCN+2KOH+Cl2→ KOCN+2KCl+H2O;被氧化的元素是___________。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,
____KOCN+_____KOH+_____Cl2→______CO2+______N2+______KCl+______H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯_______________g。
参考答案:(1)?碳(或C)?
(2) 2、4、3、2、1、6、2
(3)35.5
本题解析:
本题难度:一般
3、简答题 (1)2KClO3 2KCl+3O2↑(请用双线桥表示其电子转移情况)
(2)______KMnO4+______HCl(浓)-______KCl+______MnCl2+______Cl2↑+______H2O
(配平并用单线桥表示其电子转移情况)
(3)火药是我国古代四大发明之一.黑火药在爆炸时,反应的化学方程式如下:2KNO3+3C+S=K2S+N2↑+3CO2↑,在此反应中,属于氧化剂的是______,属于氧化产物的是______.(填写化学式)
参考答案:(1)反应中Cl元素化合价由+5价降低为KCl中-1价,氧元素由-2价升高为O2中0价,转移电子数为12,用双线桥表示其电子转移情况为: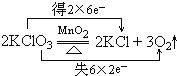 , ,
故答案为: ; ;
(2)反应中KMnO4→MnCl2,Mn元素化合价由+7价降低为+2价,共降低5价,HCl→Cl2↑,Cl元素化合价由-1价升高为0价,共升高2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,结合原子守恒配平后方程式为:2KMnO4+16 HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,反应中转移电子数目为10,标出电子转移情况为: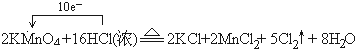 , ,
故答案为: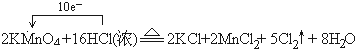 ; ;
(3)反应中N元素化合价由KNO3中+5价降低为N2中0价,S元素化合价由单质硫中0价降低为K2S中-2价,
KNO3、S是氧化剂,C元素由单质碳中的0价升高为CO2中+4价,碳发生氧化反应生成CO2,CO2是氧化产物,
故答案为:KNO3、S;CO2.
本题解析:
本题难度:简单
4、填空题 已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中 MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O MnCl2+Cl2↑+2H2O
参考答案:(6分)(1)还原(1分)?(2)失去(1分)?(3)2:1 (2分)
(4)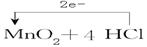 ?(2分) ?(2分)
本题解析:(1)根据反应方程式可知,二氧化锰中Mn元素的化合价从+4价降低到+2价,被还原。
(2)氯化氢中氯元素的化合价从-1价升高到0价,因此失去电子。
(3)1mol氧化剂二氧化锰得到2mol电子,1mol还原剂氯化氢失去1mol电子,因此反应中还原剂与氧化剂的物质的量之比为2:1。
(4)反应中氯化氢是还原剂,二氧化锰是氧化剂,转移2mol电子,因此电子转移情况为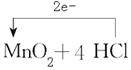 。 。
本题难度:一般
5、选择题 R2O8n-在一定条件下可以把Mn2+氧化成MnO4-,若反应中R2O8n-变为RO42-,又知反应中氧化剂与还原剂的物质的量之比为5∶2,则n值为
A.1
B.2
C.3
D.4
参考答案:B
本题解析:考查氧化还原反应的有关计算,一般遵循电子的得失守恒。锰的化合价从+2价升高到+7价,失去5个电子,所以根据电子的得失守恒可知,1mol氧化剂所得到的电子是2mol×5÷5mol=2mol。即R的在反应中得到1个电子,因此反应前R的化合价是6+1=+7价,则n=2,答案选B。
本题难度:一般
|  2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。
2AgCl+ SO42-,室温下该反应的平衡常数K=_____________[已知室温下Ksp(Ag2SO4)="6.0x" 10-5,Ksp(AgCl)="2.0x" 10-10]。