微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号
| A溶液
| B溶液
|
①
| 20 mL 0.1 mol·L-1H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液
|
②
| 20 mL 0.2 mol·L-1
H2C2O4溶液
| 30 mL 0.01 mol·L-1KMnO4溶液
|

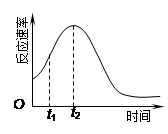
(1) 该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 - (填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),
则在2 min末,c(MnO4-)= mol/L。
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
(4)小组同学发现反应速率总是如右图,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② 。
参考答案:(1)浓度 ②>①
(2)0.0052
(3)KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间
(4)产物Mn2+(或MnSO4)是反应的催化剂
本题解析:(1)从题中可以看出H2C2O4溶液的浓度不同,KMnO4溶液而的浓度相同,说明该实验探究的是浓度对对化学反应速率的影响,并且浓度越大,反应速率越快,相同时间内针筒中所得CO2的体积为②>①;(2)中,在2 min末收集了4.48 mL CO2(标准状况下),即得到了0.0002mol CO2,根据2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O可知,消耗了0.00004mol MnO4-,则剩下的
(30*0.010/1000)-0.00004=0.00026mol,所以c=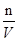 =
= mol/L=0.0052 mol/L;(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;(4)刚开始反应的时候,速率并不快,但是后来逐渐加快,这可能是由于反应放热,或者是生成了具有催化作用的物质,例如Mn2+(或MnSO4)。
mol/L=0.0052 mol/L;(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需的时间来比较化学反应速率;(4)刚开始反应的时候,速率并不快,但是后来逐渐加快,这可能是由于反应放热,或者是生成了具有催化作用的物质,例如Mn2+(或MnSO4)。
考点:影响化学反应速率的原因
点评:该题考查了影响化学反应速率的原因,是一道综合题,这有利于提高学生的综合分析能力,但是该题的难度不大,只有最后一个空有点难度,考生在解答这个空时,要联想到催化剂的作用就可以迎刃而解。
本题难度:困难
2、选择题 下列说法正确的是(? )
A.决定反应速率的因素只有催化剂
B.放在工作中的冰箱里,食物变质的速率会减慢
C.锌与稀硫酸反应时,加人少量水能加快产生氢气的速率
D.2 mol SO2与1molO2混合一定能生成2 mol SO3
参考答案:B
本题解析:A.催化剂、升高温度和反应物浓度是影响化学反应速率的因素,反应物本身的性质是内部因素,是决定化学反应速率的主要因素;A选项错误。B.温度影响化学反应速率,降低温度化学反应速率减慢。B选项正确。C.加人少量水使得稀硫酸浓度变得更稀,会减慢产生氢气的速率。C选项错误。
D.2SO2+O2 2SO3是可逆反应,反应物不能全部转化为生成物。D选项错误。
2SO3是可逆反应,反应物不能全部转化为生成物。D选项错误。
点评:这是一道考查基础概念的题目。要熟练影响化学反应速率的因素,可逆反应的限度分析。
本题难度:一般
3、选择题 10mL6mol/L H2SO4溶液与过量锌粉反应,在一定温度下,为了使产生H2的速率减缓,但又不影响生成氢气的总质量,可向反应物中加入
A.NaNO3 溶液
B.CuSO4或石墨
C.Na2SO4溶液
D.NaHSO3 或CuO
参考答案:C
本题解析:考查外界条件对反应速率的越小。要降低反应速率,则可以通过降低氢离子浓度来实现,选项C是稀释,氢离子浓度降低,但氢离子个数不变,所以选项C正确;A不正确,因为在酸性条件下,硝酸钠和锌反应得不到氢气;选项B可以构成铜锌原电池,即可反应速率,不正确;选项D中亚硫酸氢钠能消耗氢离子生成SO2不正确,所以正确的答案选C。
本题难度:一般
4、选择题 下列有关化学反应速率的说法中,正确的是
[? ]
A.用铁片与硫酸反应制取氢气时,用98%的浓硫酸可以加快产生氢气的速率
B.等质量的锌粉和锌片与相同体积、相同物质的量浓度的盐酸反应,反应速率相等
C.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以加快该化学反应的速率
D.SO2的催化氧化是一个放热反应,所以升高温度,反应速率减慢
参考答案:D
本题解析:
本题难度:一般
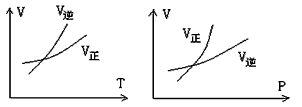
5、选择题 可逆反应mA(g) 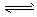 nB(g)+ pC(s),温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是
nB(g)+ pC(s),温度和压强的变化对正逆反应速率的影响分别符合图中的两个图像,以下叙述正确的是
[? ]
A.m>n,正反应放热
B.m>n+p,正反应放热
C.m>n,正反应吸热
D.m<n+p,正反应吸热
参考答案:A
本题解析:
本题难度:一般