| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《影响化学反应速率的因素》在线测试(2017年最新版)(九)
(2)现有反应③H2(g)+CO2(g)?H2O(g)+CO(g)写出该反应的平衡常数K3的数学表达式:K3=______. (3)根据反应①与②,可推导出K1、K2与K3之间的关系式______.据此关系式及上表数据,也能推断出反应③是“吸热”还是“放热”反应.问:要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______(填写序号). A.缩小反应容器容积?B.扩大反应容器容积?C.降低温度 D.升高温度?E.使用合适的催化剂?F.设法减少CO的量 (4)图1、2表示该反应③在时刻t1达到平衡、在时刻t2分别因改变某个条件而发生变化的情况: 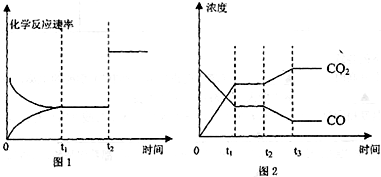 ①图1中时刻t2发生改变的条件是______ ②图2中时刻t2发生改变的条件是______. 5、选择题 参照反应Br+H2 A.正反应为放热反应 | |||||||||||||||||||||||||||||||||||||||||||
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《物质组成与.. | |