微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 实验室用H2SO4滴定氨水,选用的指示剂是
A.甲基橙
B.石蕊
C.酚酞
D.任选一种均可以
参考答案:A
本题解析:试题分析:指示剂选择一定要颜色变化明显,排除B。达到滴定中点时颜色变化范围与滴定产物酸碱性一致,H2SO4与氨水反应的产物(NH4)2SO4为酸性,故选A。
考点:考查酸碱中和滴定实验中指示剂选择的有关判断
点评:该题是基础性试题的考查,难度不大。主要是考查学生对酸碱中和实验的了解、掌握情况。该题的关键是明确指示剂的选择依据和原则,有利于培养学生实验操作的规范性和准确性。
本题难度:困难
2、选择题 某无色溶液能使石蕊变红色,经实验测知该溶液中存在Ba2+和 。则该溶液中可能存在的离子组是(?)
。则该溶液中可能存在的离子组是(?)
A.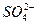 、
、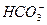 、Cl-、K+
、Cl-、K+
B.Fe3+、Na+、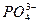 、Zn2+
、Zn2+
C.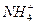 、Mg2+、Cl-、K+
、Mg2+、Cl-、K+
D.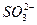 、Na+、Cl-、OH-
、Na+、Cl-、OH-
参考答案:C
本题解析:根据无色溶液能使石蕊变红色,可知溶液显酸性;根据该溶液中存在Ba2+和 ,则与这两种离子反应的应排除。
,则与这两种离子反应的应排除。
本题难度:简单
3、选择题 工业上冶炼难熔金属钒、铬、锰时常用的还原剂是
A.CO
B.H2
C.Al
D.Fe
参考答案:C
本题解析:
本题难度:简单
4、填空题 实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无
色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如下表。
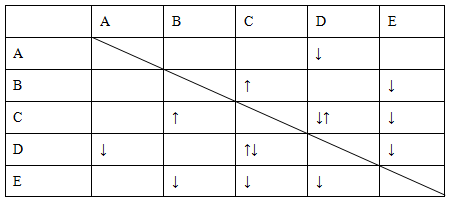
表中“↑”表示生成气体物质,“↓”表示生成沉淀。
根据以上信息,回答以下问题。
(1)B、E的化学式分别为________、________。
(2)写出A的电离方程式:________。
(3)C、D两溶液反应的离子方程式为________。
(4)向含有0.1 mol溶液的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为________mol。
参考答案:(1)NaHSO4 Ba(OH)2
(2)NH3·H2O NH4++OH-
NH4++OH-
(3)Al3++3HCO3—=Al(OH)3↓+3CO2↑
(4)0.25
本题解析:(1)C与D反应生成气体和沉淀,则C、D分别是NaHCO3、KAl(SO4)2中的一种;B与C反应只有气体生成,则B、C分别是NaHSO4、NaHCO3中的一种;据此可知C是NaHCO3,则D是KAl(SO4)2,B是NaHSO4;又由于E与B、C、D反应都有沉淀生成,故E是Ba(OH)2,A是NH3·H2O。(2)NH3·H2O是弱电解质,书写其电离方程式时要用可逆符号。(3)Al3+与HCO3—发生相互促进的水解反应。(4)当KAl(SO4)2与Ba(OH)2按1∶1.5的物质的量之比混合时,Al3+恰好完全沉淀,反应方程式为2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4;当KAl(SO4)2与Ba(OH)2按1∶2的物质的量之比混合时,SO42—完全沉淀,反应方程式为KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O。可见,当KAl(SO4)2与Ba(OH)2按1∶1.5的物质的量之比混合时,生成沉淀的物质的量最多。观察反应方程式可知0.1 mol KAl(SO4)2参与反应时生成0.25 mol沉淀。
本题难度:一般
5、填空题 某溶液中的溶质由下列中的几种离子构成:Na+、Fe3+、Cu2+、Ba2+、AlO2—、CO32—、SO32—、SO42—。取该溶液进行有关实验,实验步骤及结果如下:
①向溶液中加入过量稀盐酸,得到气体甲和溶液甲;
②向溶液甲中加入过量NH4HCO3溶液,得到白色沉淀乙、气体乙和溶液乙;
③向溶液乙中加入过量Ba(OH) 2溶液,得到白色沉淀丙、气体丙和溶液丙。
④检验气体甲、气体乙、气体丙,都只含有一种成份,而且各不相同。
请回答下列问题:
(1)只根据实验①能得出的结论是 ?(3分)
(2)沉淀丙中一定含有?(1分),可能含有?(1分)
(3)该溶液中肯定存在的离子有?
(4)气体乙分子的结构式为 ?
(5)向溶液甲中加入NH4HCO3溶液至过量,该过程中可能发生反应的离子方程式为?;?;?(根据需要,可不填完,也可补充)
参考答案:(1)至少含有CO32—、SO32—中的一种;一定不含有Fe3+ 、Cu2+、Ba2+;一定含有Na+(2)BaCO3;BaSO4(3)Na+、SO32—、AlO2—(4)O=C=O(5)HCO3—+H+=CO2↑+H 2O; Al3++3HCO3—=Al(OH)3↓+3CO2↑
本题解析:(1)通过实验①中,加入过量稀盐酸有气体产生,故溶液中至少含有CO32—、SO32—中的一种,若含有CO32—、SO32—中的一种,则,一定不能含有Fe3+ 、Cu2+、Ba2+。由于溶液中阴阳离子电荷守恒,故一定有阳离子为钠离子。(2)实验②中加入NH4HCO3溶液,得到气体乙,证明原溶液中一定不含有碳酸根,实验①中产生的气体甲为SO2,原溶液中一定含有SO32—。气体乙为二氧化碳。溶液甲中能够与NH4HCO3溶液产生白色沉淀乙只有Al3+。则产生的溶液乙中主要含有碳酸根,钠离子,碳酸氢根,氯离子,铵离子。但不能确定是否含有硫酸根离子。实验③中加入Ba(OH) 2产生的沉淀丙中一定含有BaCO3可能含有BaSO4。产生的气体丙为氨气。(3)通过上述可知,原溶液中一定含有Na+、SO32—、AlO2—三种离子。(4)气体乙为二氧化碳,故其分子结构式为O=C=O(5)甲溶液中含有的主要离子有H+、Al3+故可能发生的离子反应为HCO3—+H+=CO2↑+H 2O;Al3++3HCO3—=Al(OH)3↓+3CO2↑
本题难度:一般