| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《盐类水解的原理》高频考点巩固(2017年模拟版)(二)
参考答案:C 本题解析:本题主要考查电离和水解情况;电离出来的阴离子浓度A、B、C、D分别为0.2、0.2、0.2、0.2;由于S2-水解S2-+H2O 本题难度:一般 2、简答题 某二元酸H2A的电离情况为:H2A=H++HA-;HA-?H++A2-.请据此回答下列有关问题: 参考答案:(1)H2A的第一步电离是完全电离,第二步电离是不完全电离,所以A2-能水解导致溶液中氢氧根离子浓度大于氢离子浓度,而使溶液呈溶解性,水解离子方程式为:A2-+H2O?OH-+HA-; 本题解析: 本题难度:一般 3、选择题 部分弱酸的电离平衡常数如下表:
下列选项错误的是( ) ①2CN-+H2O+CO2=2HCN+CO32- ②2HCOOH+CO32-=2HCOO-+H2O+CO2↑ ③中和等体积、等pH的HCOOH和HCN,消耗NaOH的量前者小于后者 ④等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者 A.①② B.②③ C.③④ D.①④ 参考答案:D 本题解析:根据电离常数可知酸性HCOOH>H2CO3>HCN>HCO3-,A错误,B正确;等体积、等pH的HCOOH和HCN溶液所含溶质HCN溶液更多,则中和时消耗的NaOH的量多,C正确;根据电荷守恒,n(HCOO-)+n(OH-)=n(Na+)+n(H+),n(CN-)+n(OH-)=n(Na+)+n(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。 本题难度:一般 4、选择题 下列溶液中微粒的物质的量浓度关系正确的是 |
参考答案:C
本题解析:A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液,根据电荷守恒可得:c(H+)+ c(NH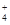 )= c(OH-)+c(Cl-),由于溶液的pH=7,所以c(H+)= c(OH-),但是盐是强电解质,电离程度远大于弱电解质水的电离,所以c(H+)= c(OH-)<c(NH4+)=c(Cl-),错误;B.0.1mol/LNa2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C.25℃时,HCOOH是弱酸,部分电离,在溶液中存在电离平衡,HCOOH的pH=2,则c(HCOOH)>10-2mol/L,NaOH是强碱,完全电离,c(NaOH)=10-2mol/L。当二者等体积混合时,n(HCOOH)>n(NaOH)。溶液是HCOONa和HCOOH的混合溶液。由于溶液显酸性,c(H+)> c(OH-),HCOOH的电离作用大于HCOONa的水解作用,所以c (HCOO-)> c(Na+),所以c (HCOO-)+ c(H+)>c(Na+)+c(OH-),正确;D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒,可得:3c(CO32-) +3c(HCO3-)+3c(H2CO3)=2c(Na+)。
)= c(OH-)+c(Cl-),由于溶液的pH=7,所以c(H+)= c(OH-),但是盐是强电解质,电离程度远大于弱电解质水的电离,所以c(H+)= c(OH-)<c(NH4+)=c(Cl-),错误;B.0.1mol/LNa2S溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),错误;C.25℃时,HCOOH是弱酸,部分电离,在溶液中存在电离平衡,HCOOH的pH=2,则c(HCOOH)>10-2mol/L,NaOH是强碱,完全电离,c(NaOH)=10-2mol/L。当二者等体积混合时,n(HCOOH)>n(NaOH)。溶液是HCOONa和HCOOH的混合溶液。由于溶液显酸性,c(H+)> c(OH-),HCOOH的电离作用大于HCOONa的水解作用,所以c (HCOO-)> c(Na+),所以c (HCOO-)+ c(H+)>c(Na+)+c(OH-),正确;D.0.1mol/LNa2CO3溶液与0.1mol/L NaHCO3溶液等体积混合,根据物料守恒,可得:3c(CO32-) +3c(HCO3-)+3c(H2CO3)=2c(Na+)。
考点:考查微粒的物质的量浓度关系正误判断的知识。
本题难度:困难
5、选择题 由下列物质所配成的0.l mol 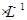 的溶液中,离子浓度由大到小的顺序正确的是
的溶液中,离子浓度由大到小的顺序正确的是
参考答案:D
本题解析:A.氯化铵属于强酸弱碱盐,水解显酸性,但水解程度非常小,所以NH4Cl溶液中离子浓度大小顺序为C(Cl-)>C(NH4+)>C(H+)>C(OH-),错误;B.碳酸钠溶液属于多元弱酸盐,分步水解,溶液显碱性,离子浓度大小顺序为C(Na+)>C(CO32-)>C(0H-)>C(HCO3-)>C(H+),错误;C.碳酸氢钠溶液显碱性,HCO3-的水解程度大于其电离程度,离子浓度大小顺序为C(Na+)>C(HCO3-)>C(0H-)>C(CO32-)>C(H+),错误;D.硫酸铵属于强酸弱碱盐,水解显酸性,离子浓度大小顺序为C(NH4+)>C(SO42-)>C(H+)>C(OH-),正确;选D。
考点:考查盐溶液中离子浓度的大小比较。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《与量有关的.. | |