微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 Q、R、X、Y、Z(Q、R、X、Y、Z分别代表元素符号)五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是 ?;在[Z(NH3)4]2+离子中,Z2+的空间轨道接受NH3分子提供的?形成配位键。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,财甲、乙的稳定性大小为? >??,甲、乙的沸点大小为 ?<?(均用相应的化学式表示)。
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为? <? <?(用元素符号作答);Q的一种氢化物相对分子质量为26,其中分子中的?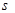 键与π键的键数之比为?。
键与π键的键数之比为?。
(4)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于?。
参考答案:
(1)(2分)1S22S22P63S23P63d9(1分);孤对电子(1分)
(2)(2分)CH4 >SiH4 (1分);CH4 <SiH4 (1分);
(3)(2分)Si<C<N(1分);3:2(1分)
(4)(2分)原子晶体
本题解析:首先根据题目所给信息推断这五种元素,Z的原子序数为29,Z为Cu,Y原子价电子(外围电子)排布msnmpn,可知n=2,为C或Si,Q、X原子p轨道的电子数分别为2和4,Q、R、X、Y、Z五种元素的原子序数依次递增,可知Q为C,R为N,X为O,Y为SI。
(1)Z2+为Cu2+,失去了4S上的2个电子,形成配位键时,Cu2+提供空轨道,NH3提供孤对电子。
(2)C、Si形成的最简单气态氢化物为CH4、SiH4,C的非金属性大于Si,所以稳定性CH4>SiH4,二者为结构相似,范德华力随相对分子质量的增大而增大,所以沸点CH4 <SiH4。
(3)C、N位于同周期,第一电离能C<N, C、Si位于同主族,第一电离能C>Si;C的一种氢化物相对分子质量为26,为乙炔,含碳碳三键,含3个σ键、2个π键,所以键数之比为3:2。
(4)五种元素中,电负性最大的非金属为O,电负性最小的非金属为Si,二者形成SiO2,为原子晶体。
本题难度:一般
2、填空题 下面是元素周期表的一部分,表中的每个字母表示一种短周期元素,请回答下列问题:
?
(1)D的最高价氧化物对应的水化物的化学式是__________。
(2)A、E两种元素中非金属较强的是___________(填元素符号)。
(3)B、C两元素的原子半径较小的是___________(填元素符号)。
(4)在盛有水的小烧杯中加入元素B的单质,发生反应的化学方程式为:
_________________________________________________________________________。
参考答案:(1)H2SiO3 (2)F (3)Mg (4)2Na+2H2O=2NaOH+H2↑
本题解析:略
本题难度:简单
3、选择题 短周期元素R的原子核外电子数等于核内中子数,该元素单质7.2g与氧气充分反应可生成12g化合物RO,则该元素的价电子层是( )
A.1s2
B.2s2
C.3s2
D.4s2
参考答案:
 C
C
本题解析:根据质量守恒定律可知,参加反应的氧气质量是4.8g,物质的量是0.15mol,得到电子的物质的量是0.15mol×4=0.6mol。根据化学式可知,R的化合价是+2价,所以根据电子的得失守恒可知,R的物质的量是0.6mol÷2=0.3mol,所以R的相对原子质量是7.2÷0.3=24,即R是Mg,所以根据构造原理可知,镁元素的价电子层是3s2,答案选C。
本题难度:一般
4、选择题 下列各组性质的比较中,不正确的是?
A.碱性:NaOH>Mg(OH)2
B.热稳定性:NH3>PH3
C.金属性:K>Na
D.原子半径:Cl>S
参考答案:D
本题解析:根据元素周期律可以确定,氢氧化物的碱性同一周期从左到右依次增强,所以碱性NaOH>Mg(OH)2 A正确;氢化物的热稳定性同一主族从上到下依次减弱,所以热稳定性NH3>PH3
B正确;金属性同一主族从上到下依次增强所以金属性K>Na C正确;原子半径同一周期从左到右依次减小,所以原子半径S>Cl,D错误;答案选D。
本题难度:一般
5、选择题 元素X、Y、Z在周期表中的相对位置如图所示:
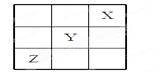
已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是(? ? )
A.X元素所在周期中所含非金属元素最多
B.Y元素在周期表的第3周期ⅥA族
C.Y元素原子的外围电子排布为4s24p4
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
参考答案:C
本题解析:Y元素原子的外围电子排布为ns(n-1)np(n+1),则Y是S,所以X是F,Z是As。所以选项C是错误的,其余都是正确的,答案选C。
本题难度:简单