微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是? ( )。
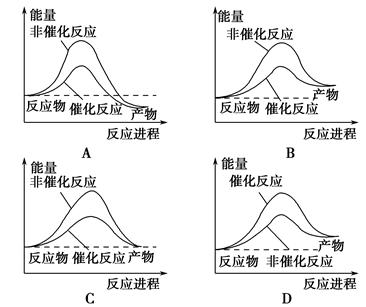
参考答案:B
本题解析:B选项正确,水分解反应是吸热反应,反应后能量变大,催化剂可以降低反应的活化能,但不能改变反应的热效应。
本题难度:一般
2、选择题 下列事实中不能用勒夏特列原理来解释的是(?)
A.向H2S水溶液中加入NaOH有利于S2-增多
B.鼓入过量空气有利于SO2转化为SO3
C.高压对合成氨有利
D.500 ℃左右比室温更有利于合成氨的反应 (合成氨反应是放热反应)
参考答案:D
本题解析:如果改变影响平衡的一个条件,则平衡就向能够减弱这种改变的方向进行,这就是勒夏特列原理,该原理适用于所有的平衡体系。氨气的合成是放热反应,根据勒夏特列原理可知,高温不利于氨气的合成,所有答案选D。
本题难度:简单
3、选择题 下列推论正确的是:
A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2
B.C(石墨,s)=C(金刚石,S)△H="+1.9" kJ/mol,则由石墨制取金刚石的反应是 吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ
D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol
参考答案:C
本题解析:A.由于同种物质在气态时含有的能量比固态时高,所以前者放出的热量比后者高,因此△H1 <△H2。错误。B.由于石墨转化为金刚石时吸收热量,说明由石墨制取金刚石的反应是吸热反应,物质所含有的能量越低该物质的稳定性就越强。因此金刚石不如石墨稳定。错误。C.NaOH(aq)+ HCl (aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,说明每有1mol的NaOH发生酸碱中和反应会放出热量57.4 kJ则:含20 gNaOH的稀溶液即NaOH的物质的量为0.5mol与稀盐酸完全反应,放出的热量为28.7 kJ.正确。D.1mol的物质完全燃烧产生稳定的氧化物时放出的热量叫该物质的燃烧热。C的稳定的氧化物是气态的CO2,因此碳的燃烧热大于110.5kJ/mol。错误。
本题难度:一般
4、选择题 下列反应过程需要吸收热量的是
A.燃烧
B.浓硫酸溶于水
C.酸碱中和
D.水的电离
参考答案:D
本题解析:略
本题难度:简单
5、选择题 已知,碳在不足量的氧气中燃烧生成一氧化碳,放出热量;一氧化碳在氧气中能继续燃烧生成二氧化碳,放出热量。反应方程式分别为( )
2C(s)+O2(g)(不足) 2CO(g);
2CO(g);
2CO(g)+O2(g)(充足) 2CO2(g)
2CO2(g)
在其他条件相同时,下列说法错误的是
A.12gC所具有的能量一定高于28gCO所具有的能量
B.56gCO和32gO2所具有的总能量一定高于88gCO2所具有的总能量
C.12gC和32gO2所具有的总能量一定高于44gCO2所具有的总能量
D.将相同质量的碳燃烧,生成CO2比生成CO放出的热量多
参考答案:A
本题解析:化学反应发生后放出热量,则反应物的总能量一定高于生成物的总能量,所以,选项B正确。由于碳在不足量的氧气中燃烧生成一氧化碳,放出热量,一氧化碳在氧气中能继续燃烧生成二氧化碳,也放出热量,所以,C与O2反应生成CO2肯定放出热量,根据C(s)+O2(g)(充足) CO2(g)和反应放出热量分析,选项C正确。若反应2C(s)+O2(g)(不足)
CO2(g)和反应放出热量分析,选项C正确。若反应2C(s)+O2(g)(不足) 2CO(g)放出的热量为?H1,反应2CO(g)+O2(g)
2CO(g)放出的热量为?H1,反应2CO(g)+O2(g) 2CO2(g)放出的热量为?H2,将这两个化学方程式相加得反应:2C(s)+2O2(g)(充足)
2CO2(g)放出的热量为?H2,将这两个化学方程式相加得反应:2C(s)+2O2(g)(充足) 2CO2(g),放出的热量为:?H1+?H2>?H1,D正确。选项A不正确,只能说“12gC和16gO2所具有的总能量一定高于28gCO所具有的总能量”,而“12gC所具有的能量不一定高于28gCO所具有的能量”。
2CO2(g),放出的热量为:?H1+?H2>?H1,D正确。选项A不正确,只能说“12gC和16gO2所具有的总能量一定高于28gCO所具有的总能量”,而“12gC所具有的能量不一定高于28gCO所具有的能量”。
故选A。
点评:(1)对于某个确定的化学反应,放出或吸收的热量与反应物的用量有关。
(2)对于一定质量的某种物质燃烧后,生成“中间产物”时放出的热量,一般比生成最终产物放出的热量小,且总能量等于各段反应放出的能量之和。
本题难度:简单