| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《认识晶体》高频试题预测(2017年最新版)(八)
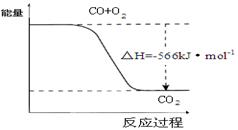 参考答案:A 本题解析:A、将等体积的1×10-3mo1/L的AgNO3溶液和1×0-3mo1/LK2CrO4溶液混合,溶液中Ag+和CrO42-浓度分别都是5×10-4mo1/L,所以此时溶液中c2(Ag+)·c(CrO42-)=(5×10-4)2×5×10-4=1.25×10-10>1.12×10-12,所以溶液中有Ag2CrO4沉淀产生,A正确;B、由于二氧化硅是原子晶体,而四氯化硅是分子晶体,所以二氧化硅的熔点高于四氯化硅的熔点,与键能大小无关系,B不正确;C、常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,根据物料守恒可知溶液中2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),C不正确;D、根据热化学方程式可知,反应物是2molCO与1mol氧气化合生成2molCO2时放出的热量是566kJ,而图像中物质的物质的量不符合,D不正确,答案选A。 本题难度:一般 4、选择题 下列叙述肯定正确的是 参考答案:B 本题解析:A选项中,如Na2O2存在非极性键;B中分子晶体一定不含离子键;C中如NH4Cl为离子化合物,但全部由非金属元素组成;D中如稀有气体,它们是单原子分子,但它们构成的晶体是分子晶体。 本题难度:简单 5、选择题 金属的下列性质中,不能用电子气理论加以解释的是( ) 参考答案:D 本题解析:金属易锈蚀,是因为在反应中易失去最外层电子,具有较强的还原性。 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《能量的相互.. | |