| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学实验的基本操作》高频考点强化练习(2017年最新版)(六)
(3)D中30% 双氧水的作用是?;若无此装置,所测定的含碳量将?(填“偏高”、“偏低”或“不影响”) (4)反应完成后,欲验证生铁含有硫元素,你所设计的实验方案是(写出实验步骤、现象)?; (5)待C管的样品充分反应后,测得E中生成的沉淀为bg,请计算出生铁中的含碳量为?; (6)实验过程中,该兴趣小组应注意的安全问题是?。(任写一种) 参考答案:(1)A (2分) 本题解析:(1)铁的化合价一定为正价,而碳的非金属小于硫的非金属性,因此S一定显示负价,故A项正确。 本题难度:一般 2、选择题 下列实验操作正确且能达到预期目的的是(?)
参考答案:C 本题解析:钠和水反应要比钠和乙醇反应剧烈,据此可以比较水和乙醇中羟基氢的活泼性强弱,①正确;②中在酸性条件下,NO3-具有氧化性,能把SO32-氧化生成SO42-,所以不能证明溶液中含有SO42-,②不正确;③不正确,酸性高锰酸钾溶液具有强氧化性,能把SO2氧化,所以体现的是SO2的还原性;金属性越强,相应阳离子的氧化性越弱,所以可以通过电解池中阴极阳离子的放电顺序来比较金属性强弱,④正确;非金属性越强,最高价氧化物的水化物的酸性越强,则相应的含氧酸盐的水解程度越小,⑤正确,答案选C。 本题难度:一般 3、选择题 下列说法不正确的是 |

参考答案:A
本题解析:A 错误,本质区别是分散质微粒直径的大小
B 正确,加入新制的氢氧化铜悬浊液,无明显现象的是乙醇;变为绛蓝色溶液的是甘油;加热产生砖红色沉淀的是乙醛;悬浊液变澄清的是乙酸;溶液分层,上层为油状液体的为乙酸乙酯;开始为将蓝色溶液,加热后变为砖红色沉淀的是葡萄糖。
C 正确,温度适宜时,催化剂的催化效率最好,当温度高时,酶失去生理活性,催化效率减慢。
D 正确,可以加入氢氧化钠溶液,苯酚和氢氧化钠反应,溶于水,苯不溶,分层即可。
本题难度:一般
4、填空题 下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒?(b)容量瓶?(c)滴定管 ?(d)托盘天平? (e)温度计
(1)无“0”刻度的是?(填写编号)。
(2)下列操作合理的是?(填字母)
A.用25mL碱式滴定管量取20.00mLNaHCO3
B.用托盘天平准确称量10.20克碳酸钠固体
C.用100mL量筒量取3.2mL浓硫酸
D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶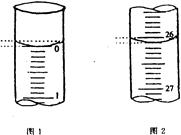
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如上图所示:则所用盐酸溶液的体积为?mL。
(4)图甲表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积为?mL;图乙表示25 mL酸式滴定管中某酸的体积,D与E 之间的刻度差为1 mL,如果刻度D为4,则该酸式滴定管中液体体积的读数为?mL。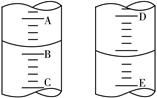
图甲?图乙
参考答案:(1) ab?(2) AD?(3) 26.10mL?(4)3.2mL? 4.60mL
本题解析:(1)量筒和容量瓶没有“0”刻度;(2)托盘天平精确度为0.1g,不能精确称量10.20克碳酸钠固体;用100mL的量筒量取3.2mL浓硫酸造成的误差较大,应该用10mL的量筒量取,故B、C错误,A、D操作合理;(3)滴定前液面读数为0.00mL,滴定后液面读数为26.10mL,故所用盐酸的体积为26.10ml;(4)量筒刻度自下而上逐渐增大,若甲图中刻度A为4,则B为3,最小刻度为0.2mL,根据液面高度可判断量筒中液体的体积为3.2mL;滴定管刻度自上而下依次增大,乙图中如果刻度D为4,则E为5,最小刻度为0.1mL,由液面高度可判断滴定管中液体体积的读数为4.60mL(注意精确到0.01mL)。
本题难度:一般
5、选择题 右下图装置可用于多项定量实验。图中夹持固定装置已略去,甲有刻度,供量气用。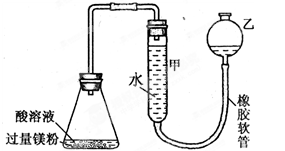
( 1 )装置中有刻度的甲管可以用______________代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是______________________________
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同。装置如右图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH 0.1 mol/L 40.00mL | HCl溶液 0.1 mol/L 40.00mL | 5 | t(a1)="155" s | t(b1)="7" s |
| 10 | t(a2)="310" s | t(b2)="16" s | ||
| 15 | t(a3)="465"  s s | t(b3)="30" s | ||
| 20 | t(a4)="665" s | t(b4)="54" s | ||
| …… | …… | …… | ||
 ________。
________。参考答案:( 1 )? _?碱式滴定管_______________,
1 )? _?碱式滴定管_______________,
(3)?①_____Zn+2OH-+2H2O=__[Zn(OH)4_]2-__+ H2_↑_________________?
② ____分液漏斗_____ ;③ ______65V×10-3_/_2ρSVm_______。
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《分子式、结.. | |