微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某学习小组利用下列装置探究氯气氨气之间的反应,其中A、F分别为氯气和氨气的发生装置,D为纯净的氯气和氨气的反应装置。?
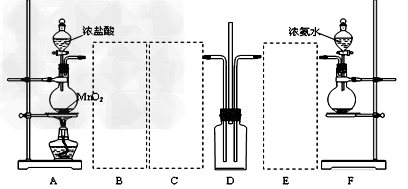
请回答下列问题:
(1)?装置F中烧瓶内的固体可选用_____________。
A、氯化铝?B、生石灰?C、五氧化二磷?D、烧碱
(2)实验中所用的浓盐酸的质量分数为36.5%,其密度为1.19?g/cm3,则其物质的量浓度为__________(保留一位小数),在标况下需____________L(保留一位小数)氯化氢溶于1L水中才可得此浓度的盐酸。
(3)虚线框内应添加必要的除杂装置,请将除杂装置中相应的试剂名称填入下列空格中:B__________;C_____________;E_____________。
(4)装置D内出现白烟并在容器内壁凝结,鉴定该固体中的阳离子所需要的试剂有:?__________。写出装置D中反应的化学方程式___________。该反应中氧化剂与还原剂物质的量之比为____________。
参考答案:(1)BD?
(2)11.9mol/L;352.7?
(3)饱和食盐水;浓硫酸;碱石灰
(4)NaOH溶液和湿润的红色石蕊试纸?;8NH3+3Cl2?=?N2+6NH4Cl?;3:2
本题解析:
本题难度:一般
2、选择题 a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且a、d反应时无明显现象;b与d反应只产生气泡;e只能与a反应.下列推理不正确的是( )
A.a一定为KOH溶液
B.b一定为KHSO4溶液
C.c一定为AlCl3溶液
D.e一定为MgCl2溶液
参考答案:MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中,KOH能与其余四种溶液反应,故a为KOH,MgCl2只能与KOH反应,e为MgCl2,KHSO4、KOH之间的反应没有明显现象,所以d为KHSO4,KHSO4和NaHCO3反应只产生气泡,所以b为NaHCO3,c为AlCl3.
A、a为KOH,故A正确;
B、b为NaHCO3,故B错误;
C、c为AlCl3溶液,故C正确;
D、e为MgCl2,故D正确.
故选B.
本题解析:
本题难度:简单
3、填空题 (9分)(1)某实验需要用1.0mol·L-1 NaOH 溶液450mL。配制该溶液所需要的玻璃仪器有?;
(2)配制实验操作步骤有:a.在天平上称量?g NaOH固体放入烧杯中,加水溶解,冷却至室温。b.把制得的溶液小心地注入一定容积容量瓶中。c.继续向容量瓶中加水至距刻度线1cm~2cm处,改用胶头滴管加水至刻度线。d.用少量水洗涤烧杯和玻璃棒2~3次,每次将洗涤液转入容量瓶,并摇匀。e.将容量瓶塞塞紧,充分摇匀。填写下列空白:
①操作步骤和正确顺序为? ?。
?。
②该配制过程中两次用到玻璃棒,其作用分别是?、? ?。
?。
③定容时,若俯视凹液面,会使结果?(填“偏高”、“偏低”或“无影响”)
④若没有进行d步操作,会使结果?(填“偏高”、“偏低”或“无影响”)
⑤在进行b步操作时,不慎有液体溅出,下列处理措施正确的是(?)
A.继续进行实验
B.添加部分NaOH溶液
C.倒掉溶液,重新配制
D.倒掉溶液,洗净容量瓶后重新配制
参考答案:(9份)(1)500mL 容量瓶 烧杯 玻璃棒 胶头滴管 (2分)
(2)(每空1分)20.0 ① a b dc e ②搅拌加速溶解 引流 ③偏高 偏低 D
本题解析:略
本题难度:一般
4、实验题 某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
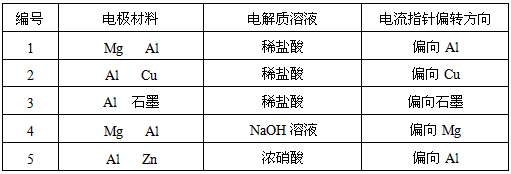
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极是否相同?____________。
(2)写出实验3中的电极反应式。
铝为( )_____________________________________;
石墨为( )___________________________________;
(3)实验4中的铝作正极还是负极?写出电池总反应方程式。
________________________________________
(4)解释实验5中电流指针偏向铝的原因。
________________________________________
(5)根据实验结果总结:在原电池中金属铝作正极还是作负极受哪些因素的影响?
________________________________________
参考答案:
(1)不同
(2)负极;2Al-6e-==2Al3+;正极;6H++6e-==3H2↑
(3)负极;电池总反应式:2Al+2NaOH+6H2O==2Na[Al(OH)4]+3H2↑
(4)由于铝在浓硝酸中发生钝化,反以锌为负极
(5)与另一种材料的活泼性、电解质溶液的酸碱性以及电解质溶液的氧化性强弱等因素有关
本题解析:
本题难度:困难
5、简答题 (一)某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:

(1)浓硫酸的作用是______.
(2)B中观察到的实验现象是______.
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理______
(二)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的微粒是______.上述溶液逐渐褪去,起作用的微粒是______.
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的微粒是______.
(三)在标准状况下,35.5g氯气的体积是______L,将其与氢气完全化合,需氢气的物质的量是______mol,将生成的气体制成1L溶液,溶质的物质的量浓度是______mol?L-1,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是______mol?L-1.
参考答案:(一)(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气,
故答案为:除去氯气中的水蒸气;
(2)干燥氯气不具有漂白性,装置B中的有色布条不褪色;
故答案为:不褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,装置图为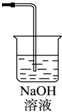 ;
;
故答案为: ;Cl2+2NaOH=NaCl+NaClO+H2O;
;Cl2+2NaOH=NaCl+NaClO+H2O;
(二)酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;
次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子;
银离子和氯离子能生成不溶于稀硝酸的白色沉淀,所以加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是氯离子.
故答案为:H+;HClO;Cl-;
(三)在标准状况下,35.5g氯气的体积是V=n×Vm=mM×Vm=35.5g71g/mol×22.4L/mol=11.2L;
由H2~Cl2~2HCl可知n(H2)=n(Cl2 )=35.5g71g/mol=0.5mol;n(HCl)=2n(Cl2 )=1mol;
将生成的气体制成1L溶液,溶质的物质的量浓度是1mol1L=1mol/L;
设稀释后溶液的浓度为C,则1mol/L×20mL=C×200mL,解得:C=0.1mol/L;
故答案为:11.2;0.5;1;0.1.
本题解析:
本题难度:一般