微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 H2O2是重要的化工原料。
(1)H2O2中O元素的化合价为______。
(2)①向酸性KMnO4溶液中滴加H2O2溶液,溶液褪色,体现了H2O2的还原性,其中氧化过程是:H2O2→______(填化学式)。
②向H2SO4酸化的FeSO4溶液中滴加H2O2溶液,溶液变成黄色,体现了H2O2的氧化性,反应的离子方程式是_________。
(3)H2O2不稳定易分解。实验室需要448 mL O2(标准状况),则理论上最少需要用30%的H2O2溶液(密度为1.10 g/mL)_______mL。(计算结果保留一位小数)
参考答案: (1)-1 (2)① O2 ② 2Fe2+ + H2O2 + 2H+ =2Fe3+ + 2H2O (3)4.1
本题解析:(1)H2O2中H是+1价,根据化合价的代数和为零,O为-1价;(2)溶液变成黄色,说明生成了Fe3+,H2O2体现氧化性,H2O2转变成H2O,因此离子反应方程式:2Fe2++H2O2+2H+=2Fe3++2H2O;(3)2H2O2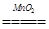 2H2O+O2↑,设最少需要H2O2vmL根据题意得出:
2H2O+O2↑,设最少需要H2O2vmL根据题意得出: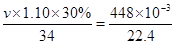 ×2解得v=4.1。
×2解得v=4.1。
考点:考查H2O2的性质。
本题难度:一般
2、选择题 在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g/cm3,溶
质的质量分数为w,其中含NH4+的物质的量为b mol。下列叙述中正确的是( )
A.溶质的质量分数为w= ×100%
×100%
B.溶质的物质的量浓度c=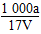 mol/L
mol/L
C.溶液中c(OH-)=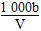 mol/L
mol/L
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5 w
参考答案:B
本题解析:根据题中给的已知量及各小题的要求,利用待求量的最基本计算关系代入求解即可。A不正确,w应为 ×100%;根据公式c=
×100%;根据公式c=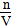 进行计算知B正确;由溶液中的电荷守恒可知C不正确;因为氨水的密度小于水的密度,故上述溶液再加V mL水后,所得溶液溶质的质量分数小于0.5 w,D不正确。
进行计算知B正确;由溶液中的电荷守恒可知C不正确;因为氨水的密度小于水的密度,故上述溶液再加V mL水后,所得溶液溶质的质量分数小于0.5 w,D不正确。
本题难度:一般
3、选择题 设NA代表阿伏加德罗常数的数值。已知C2H4和C3H6的混合物的质量为a g,则该混合物( )
A.所含共用电子对数目为( +1)NA
+1)NA
B.所含碳氢键数目为 NA
NA
C.燃烧时消耗的O2一定是 L
L
D.所含原子总数为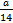 NA
NA
参考答案:B
本题解析:其最简式均为CH2,n(CH2)= ?mol,一个CH2可形成三个共用电子对,所含共用电子对数=
?mol,一个CH2可形成三个共用电子对,所含共用电子对数=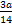 ?mol,A选项错误;一个氢原子形成一个碳氢键,共含有
?mol,A选项错误;一个氢原子形成一个碳氢键,共含有 ?mol氢原子,B选项正确;C选项没有注明标准状况下,错误;所含原子总数=
?mol氢原子,B选项正确;C选项没有注明标准状况下,错误;所含原子总数=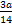 ?mol,D选项错误
?mol,D选项错误
本题难度:一般
4、选择题 将10mL0.5mol/L的NaOH溶液加水稀释到500mL,取出稀释后的溶液100mL,则这100mL溶液的物质的量浓度是( )
A.0.01mol/L
B.0.05mol/L
C.0.002mol/L
D.0.1mol/L
参考答案:令稀释后溶液中NaOH的物质量浓度为c,则:
10×10-3L×0.5mol/L=500×10-3L×c
解得c=0.01mol/L.
溶液是均匀的,从稀释后溶液中取出100mL溶液的浓度与稀释为500mL溶液的浓度相等为0.01mol/L,
故选:A.
本题解析:
本题难度:一般
5、选择题 有Na2SO4和Al2(SO4)3的混合溶液,已知其中c(Al3+)= 0.4mol/L,c(SO42-)=" 0.7" mol/L,则此溶液中c(Na+)为
A.0.1mol/L
B.0.2mol/L
C.0.15mol/L
D.0.25mol/L