微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法不正确的是
A.燃着的酒精灯不慎碰翻失火,应该迅速用湿抹布扑盖
B.用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量。
C.制备摩尔盐的过程中,洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分
D.在适量氯化钴的乙醇溶液中,逐滴加入水至溶液恰好呈粉红色,加热该溶液,结果依次呈现紫色、蓝紫色、蓝色的变化
参考答案:B
本题解析:
A、正确;
B、使用电子天平称量药品时,不使用烧杯,错误;
C、用酒精洗涤晶体,酒精挥发能带走晶体表面的水分且能减少晶体的溶解,正确;
D、CoCl2·6H2O(粉红色)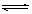 CoCl2·2H2O(紫色)
CoCl2·2H2O(紫色)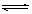 CoCl2·H2O(蓝紫色)
CoCl2·H2O(蓝紫色)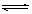 CoCl2(蓝色),正确。
CoCl2(蓝色),正确。
本题难度:一般
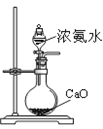
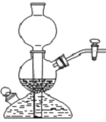
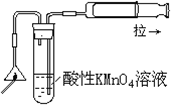
2、选择题 某课外实验小组设计的下列实验合理的是

| 
| 
| 
|
A.制备Fe(OH)2
| B.制备少量氨气
| C.实验室制备乙炔
| D.检验火柴头燃烧产生的SO2
参考答案:B
本题解析:A错,正确装置为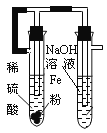 ,先利用铁与稀硫酸反应生成氢气将装置内的空气排尽,再将左边试管的橡皮管用弹簧夹夹紧,使左边试管内液体被挤压入右边试管内; ,先利用铁与稀硫酸反应生成氢气将装置内的空气排尽,再将左边试管的橡皮管用弹簧夹夹紧,使左边试管内液体被挤压入右边试管内;
B正确,浓氨水中存在平衡:NH3+H2O?NH3·H2O?NH4++OH—;加入CaO,使平衡向逆反应方向移动,同时CaO溶于水放热,利用氨水的挥发。
C错,实验室乙炔的制备不能用启普发生器,启普发生器装置使用于(块状)固体+液体→气体的装置,由于乙炔制备所需的原料为电石和水,电石溶于水且生成微溶于水的氢氧化钙沉淀易堵塞装置。同时反应会放出大量的热量会使启普发生器炸裂。
D错,二氧化硫气体无可燃性,不能燃烧。
本题难度:一般
3、选择题 下列说法正确的是( )
A.实验室保存硝酸银溶液用棕色细口试剂瓶,而钠保存在盛有煤油的无色广口试剂瓶中
B.给盛有液体量占试管容积 的试管加热
C.用胶头滴管向容器中加液体时,一定不能把滴管伸入容器内
D.称取2.60?g?NaCl必须用到的仪器有托盘天平、药匙、小烧杯等
参考答案:A.硝酸银见光易分解,溶液保存着细口瓶里,所以硝酸银溶液保存着棕色细口瓶中;钠易和水、氧气反应,所以要密封保存,钠的密度大于煤油且和煤油不反应,所以钠保存在盛有煤油的无色广口试剂瓶中,故A正确;
B.试管加热时液体不能超过试管容积的13,故B错误;
C.一般来说,滴管滴加溶液时不能伸入容器内,但实验室制备氢氧化亚铁沉淀时,滴管要伸入容器内,故C错误;
D.托盘天平的感量是0.1g,所以无法称取2.60?g?NaCl,故D错误;
故选A.
本题解析:
本题难度:一般
4、选择题 实验室需用2mol·L-1氯化钠溶液450 mL,配制时应选用容量瓶的规格和称取氯化钠的质量分别是
A.450 mL,52.7 g
B.500 mL,58.5 g
C.450 mL,58.5 g
D.500 mL,52.7 g
参考答案:B
本题解析:实验室没有450mL的容量瓶,应用500mL的容量瓶进行配制,根据n=cV及m=nM进行计算。 n(NaCl)=0.5L×2 mol·L-1=1mol,m(NaCl)=1mol×58.5 g·mol-1=58.5g,选C。
本题难度:一般
5、实验题 (12分)
(1)下图所示是实验室中制取气体的一种简易装置
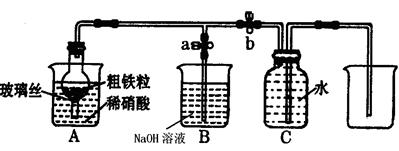
①.甲同学用下列方法检验发生装置的气密性,请问能否达到目的??(填能或否)
关闭止水夹a和b,从A处烧杯中加入水,使干燥管与烧杯中液面形成液面差,一段时间后,液面差没有变化,说明气密性良好。
②.实验室利用上图所示发生装置可以制取下列?气体。
A.Cl2
B.CO2
C.NH3
D.SO2
|
(2)乙同学利用该图所示装置,用粗铁粒与3mol·L-1硝酸反应制取NO气体。请回答有关问题。
①NO气体能用排水法收集,而不能用排空气法收集的原因是?。
②制取NO时,向A杯中加入稀硝酸,同时打开止水夹a,关闭止水夹b,A装置的干燥管中观察到气体的颜色的变化为?。
B装置烧杯中NaOH溶液的作用是?。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
③将a mol铁与含b molHNO3的稀溶液充分反应后,若HNO3的还原产物只有NO,反
应后Fe和HNO3均无剩余,则反应中转移电子的物质的量为?mol(用含b的代数式示)。
参考答案:(1)①能? (2分)?②B? (2分)
(2)①NO与空气中的O2反应;(2分)?
②红棕色,(2分)?;?吸收NOx?(2分),;?③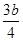 mol? (2分)
mol? (2分)
本题解析:(1)①如果装置不漏气,则干燥管内液面变化变化,所以是正确的。
②制取氯气需要加热,氨气和SO2易溶于水,均不能用此装置,所以答案选B。
(2)①NO极易被氧气氧化生成NO2,所以不能用排空气法收集。
②反应生成NO,但是装置内有残留的空气,所以无色气体被氧化生成红棕色NO2。氮氧化物但是污染性气体,需要尾气处理。
③根据反应式Fe+4HNO3=Fe(NO3)3+NO↑+2H2O和3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O可知,被还原的硝酸但是参加反应的硝酸的1/4,所以反应中转移电子是3b/4mol。
本题难度:一般