|
高中化学知识点归纳《物质的量》答题技巧(2017年最新版)(六)
2017-08-22 15:09:03
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (10分)实验室用Na2SO4·10H2O配制0.1mol/L的Na2SO4溶液500ml。有以下仪器:
①药匙 ②100ml量筒 ③1000ml容量瓶 ④锥形瓶 ⑤玻璃棒⑥烧杯
(1)配制时,必须选用的仪器为: (填代号),还缺少的玻璃仪器为
(2)经计算,本实验需称量硫酸钠晶体(Na2SO4·10H2O)为 g。
(3)用Na2SO4·10H2O配制标准溶液的正确顺序是 。
A.冷却
B.称量
C.洗涤
D.定容 E.溶解 F.摇匀 G.移液
| (4)将所配制的Na2SO4溶液进行测定,发现浓度大于0.1mol/L。请你分析配制过程中可能引起该误差的原因是(填字母代号)
①容量瓶不干燥,含有少量蒸馏水 ②定容时俯视刻度线 ③定容时仰视刻度线 ④未冷却至室温就转移到容量瓶中 ⑤没有洗涤烧杯和玻璃棒
参考答案:(10分每空2分)(1)①②⑤⑥ 500ml容量瓶、胶头滴管
(2)16.1 (3)BEAGCGDF (4)②④
本题解析:查一定物质的量浓度溶液的配制以及有关误差分析等。
(1)固体需要称量,所以需要药匙,溶解在烧杯中进行,因此还需要烧杯以及搅拌的玻璃棒和盛放蒸馏水的100ml量筒。配制500ml溶液,所以还缺少的玻璃仪器是500ml容量瓶,以及定容时需要的胶头滴管。
(2)硫酸钠的物质的量是0.1mol/L×0.5L=0.05mol,则需要硫酸钠晶体的质量是0.05mol×322g/mol=16.1g。
(3)根据配制原理以及实验要求可知,配制时,正确的操作顺序是BEAGCGDF。
(4)根据c=n/V可知,如果容量瓶不干燥,含有少量蒸馏水,则不会影响实验结果;定容时俯视刻度线,则容量瓶中溶液的体积偏少,因此浓度就偏高;反之定容时仰视刻度线,测定结果偏低;未冷却至室温就转移到容量瓶中,则根据热胀冷缩可知,容量瓶中溶液的体积偏少,因此浓度就偏高;没有洗涤烧杯和玻璃棒,则溶质减少,浓度偏低,所以正确的答案选②④。
本题难度:一般
2、选择题 NA代表阿伏加德罗常数,下列说法正确的是
A.1 L0.1 mol/L Na2CO3溶液中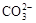 和HCO—3总数为0.1 NA 和HCO—3总数为0.1 NA
B.22.4L氢气和4g氦气均含有NA个分子
C.含2NA共价键的CnH2n+2分子的物质的量为2/(3n+l) mol
D.标准状况下,2.24LCl2与稀NaOH溶液反应,转移的电子总数为0.2NA
参考答案:C
本题解析:A不正确,不符合物料守恒;B不正确,因为气体的状态是未知的;CnH2n+2分子中(3n+1)个共价键,C正确;氯气和氢氧化钠溶液反应中,氯气既是氧化剂也是还原剂,转移1个电子,D不正确,答案选C。
本题难度:一般
3、选择题 在VL硫酸铝溶液中,含有Wg?Al3+,则溶液中SO42-物质的量浓度为( )
A.W/27V
B.W/54V
C.W/18V
D.W/9V
参考答案:Wg?Al3+的物质的量为Wg27g/mol=W27mol,
根据电荷守恒3n(Al3+)=2n(SO42-),所以n(SO42-)=32n(Al3+)=32×W27mol=W18mol,
故溶液中SO42-的浓度为:W18molVL=W18Vmol/L,
故选C.
本题解析:
本题难度:简单
4、选择题 三种正盐的混合溶液中含有0.2molNa+,0.25molMg2+,0.4molCl-,则SO42-的物质的量为( )
A.0.1?mol
B.0.3?mol
C.0.5?mol
D.0.15?mol
参考答案:溶液呈电中性,根据电荷守恒有n(Na+)+2n(Mg2+)=n(Cl-)+2n(SO42-),故
0.2mol×1+0.25mol×2=1×0.4mol+2n(SO42-)
解得:n(SO42-)=0.15mol,
故选D.
本题解析:
本题难度:一般
5、选择题 为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1 g 样品加热,其质量变为w2 g ,则该样品的纯度(质量分数)是(? )

A.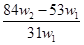
B.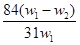
C.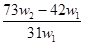
D.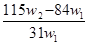
参考答案:  A A
本题解析:根据
2NaHCO3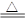 Na2CO3+H2O+CO2?△m Na2CO3+H2O+CO2?△m
2×84? 106? 62
m(NaHCO3)? w1-w2
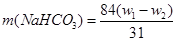
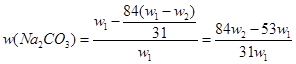
本题难度:一般
|