微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.氯水的颜色呈浅绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
参考答案:D
本题解析:A、氯气是黄绿色气体,因此氯水的颜色呈浅绿色,说明氯水中含有Cl2,A正确;B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,白色沉淀是氯化银,这说明氯水中含有Cl-,B正确;C、向氯水中加入NaHCO3粉末,有气泡产生,气体是CO2,这说明氯水中含有H+,C正确;D、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明反应中有氯化铁生成。由于氯气也能把氯化亚铁氧化生成氯化铁,因此不能说明氯水中含有HClO,D不正确,答案选D。
本题难度:一般
2、实验题 四氯化锡常温下是无色液体,在空气中极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃。装置A中放浓盐硫,B中放MnO2,二者用于制氯气,用熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡(此反应过程放出大量的热)。请回答下列各问题。

(1).上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________________。
利用改进后的正确装置进行实验,请回答下列问题:
(2)H中反应的离子方程式:_________________________________________________;
E中反应的化学方程式:________________________________________________。
(3)C、D中的试剂分别是_______________、____________________。
(4)仪器A、B的名称分别是_____________、____________,F的作用是_____________。
(5)实验时应先点燃_________处酒精灯,加热温度应大于________ ℃,待________,即可停止加热。
(6)已知四氯化锡遇水强烈水解,产物之一是固态二氧化锡,那么四氯化锡水解的化学方程式为________________________________________________________________。
(7)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是___________________________。
参考答案:(
(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗(1分)在G和H之间增加干燥装置(1分)
(2)Cl2+H2O=Cl―+ClO―+H2O(2分)Sn+2Cl2 SnCl4(2分)
SnCl4(2分)
(3)饱和食盐水(或水)(1分)浓硫酸(1分)
(4)分液漏斗(1分)蒸馏烧瓶(1分)导气、冷凝(2分)
(5)E(1分)231℃(1分)Sn粒熔化(1分)
(6)SnCl4+2H2O=SnO2+4HCl(2分)
(7)出现白色烟雾(1分)
本题解析:(1)发生装置中生成气体,压强增大,分液漏斗中的盐酸不能顺利加到圆底烧瓶中,应用导管将A的上口与B相连,以平衡分液漏斗与圆底烧瓶中的压强,四氯化锡极易水解,G为收集四氯化锡装置,应在G、H之间增加干燥装置防止H中的水蒸气加入G装置,答案为:用导管将A的上口与B相连;在G、H之间增加干燥装置;
(2)H为吸收为反应的氯气,氯气与氢氧化钠反应生成氯化钠、次氯酸钠、水,反应离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,由装置图可知,E中为金属锡跟干燥的氯气反应生成无水四氯化锡,反应方程式为:Sn+2Cl2 SnCl4,答案为:Cl2+2OH-=Cl-+ClO-+H2O;Sn+2Cl2
SnCl4,答案为:Cl2+2OH-=Cl-+ClO-+H2O;Sn+2Cl2 SnCl4;
SnCl4;
(3)四氯化锡极易水解,进入装置E的气体应干燥、纯净,装置C的作用为吸收挥发出的HCl,用饱和食盐水吸收HCl,装置D的作用为吸收水蒸气、干燥气体,用浓硫酸吸收干燥,答案为:饱和食盐水;浓硫酸;
(4)仪器A为分液漏斗,B为蒸馏烧瓶,F起导气、并冷凝四氯化锡蒸气,答案为:分液漏斗;蒸馏烧瓶;导气、冷凝;
(5)熔融的金属锡跟干燥的氯气直接作用制取无水四氯化锡,故应向加热E酒精灯,加热温度应大于金属锡的熔点,当锡融化后停止加热,答案为:E;231;锡融化;
(6)四氯化锡遇水强烈水解,由水解原理可知,应生成Sn(OH)4、HCl,产物之一是固态二氧化锡,说明Sn(OH)4分解生成SnO2与H2O,故四氯化锡水解生成SnO2、HCl,反应方程式为:SnCl4+2H2O=SnO2+4HCl,答案为:SnCl4+2H2O=SnO2+4HCl;
(7)四氯化锡遇水强烈水解生成SnO2、HCl,SnO2是固体颗粒,HCl结合空气中的水蒸气,出现白色烟雾,答案为:出现白色烟雾.
本题难度:一般
3、选择题 今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol·L-1。如果在甲瓶中加入少量的NaHCO3晶体(m mol),在乙瓶中加入少量的NaHSO3晶体(m mol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中的HClO的物质的量浓度的大小关系是(溶液体积变化忽略不计)?(?)
A.甲=乙>丙
B.甲>丙>乙
C.丙>甲=乙
D.乙>丙>甲
参考答案:B
本题解析:氯水中存在如下平衡: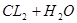 ?
?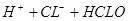 ,若在甲瓶中加入少量的NaHCO3晶体,则使氯水中氢离子浓度减少,平衡向右移动,溶液中HCLO的浓度增大;若在乙瓶中加入少量的NaHSO3晶体,被氯气氧化,使平衡向左移动,溶液中HCLO的浓度减小;所以正确关系为:甲>丙>乙
,若在甲瓶中加入少量的NaHCO3晶体,则使氯水中氢离子浓度减少,平衡向右移动,溶液中HCLO的浓度增大;若在乙瓶中加入少量的NaHSO3晶体,被氯气氧化,使平衡向左移动,溶液中HCLO的浓度减小;所以正确关系为:甲>丙>乙
本题难度:一般
4、实验题 实验室里用下图所示装置制取纯净的无水CuCl2。试回答下列问题:
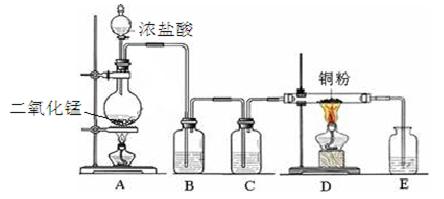
(1)写出烧瓶中发生反应的离子方程式 ?。
(2)B处盛有饱和食盐水(或水),其作用是?。
(3)C处盛放的试剂__________(填名称),其作用是?。
(4)E处盛有___________(填名称),发生反应的离子方程式为_________。
(5)实验结束时,应先熄灭__________处酒精灯。
参考答案:(10分) (1) MnO2 + 4H+ + 2Cl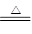 Mn2+ + 2H2O + Cl2↑
Mn2+ + 2H2O + Cl2↑
(2)除杂质H Cl气体(3)浓硫酸;吸收水份,干燥氯气
(4)NaOH 溶液,2OH- + Cl2=Cl- + ClO-+H2O?(5) D
本题解析:(1)装置A是制备氯气的,则反应的离子方程式是MnO2 + 4H+ + 2Cl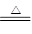 Mn2+ + 2H2O + Cl2↑。
Mn2+ + 2H2O + Cl2↑。
(2)盐酸易挥发,生成的氯气中含有氯化氢气体,则B处盛有饱和食盐水(或水)的作用是除杂质H Cl气体。
(3)和铜反应的氯气应该是干燥的,则C中盛放的是浓硫酸,用来干燥氯气。
(4)氯气有毒,则E中盛放的是氢氧化钠溶液,用来吸收氯气,防止污染空气,发生反应的离子方程式为2OH- + Cl2=Cl- + ClO-+H2O。
(5)由于在加热的条件下,铜容易被氧化生成氧化铜,所以实验结束时,应先熄灭D处酒精灯。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,也有助于调动学生的学习兴趣和学习积极性。
本题难度:一般
5、选择题 对下列事实的解释错误的是
A.氨溶于水的喷泉实验,说明氨气极易溶于水
B.常温下,浓硝酸可用铝罐来贮存,说明浓硝酸具有强氧化性
C.向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有吸水性
D.氯气可使湿润的红色布条褪色,而不能使干燥的有色布条褪色,说明次氯酸具有漂白性
参考答案:C
本题解析:A、氨气极易溶于水,可以做喷泉实验。因此氨溶于水的喷泉实验,可以说明氨气极易溶于水,A正确;B、常温下铝在浓硝酸中钝化,所以常温下,浓硝酸可用铝罐来贮存,可以说明浓硝酸具有强氧化性,B正确;C、浓硫酸具有脱水性,能使蔗糖炭化,所以向蔗糖中加入浓硫酸后出现发黑现象,说明浓H2SO4具有脱水性,C不正确;D、氯气可使湿润的红色布条褪色,而不能使干燥的有色布条褪色。由于氯气溶于水生成盐酸与次氯酸,由此说明次氯酸具有漂白性,D不正确,答案选C。
本题难度:一般