微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.某工厂使用还原沉淀法处理,该法的工艺流程为:

其中第①步存在平衡:2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,则溶液显______色.
(2)能说明第①步反应达平衡状态的是______.
a.Cr2O72-的浓度不变?b.Cr2O72-和CrO42-的浓度相同
c.2v(Cr2O72-)=v(CrO42-)?d.溶液的颜色不变
(3)第②步反应中,还原剂为______,该还原剂反应后生成______.
(4)电镀废液中Cr2O72-还可通过下列反应转化:
Cr2O72-(aq)+2Pb2+(aq)+H2O(l)═2PbCrO4(s)+2H+(aq)△H<0
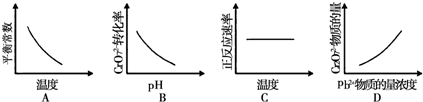
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是______
参考答案:(1)若平衡体系的pH=12,2CrO42-(黄色)+2H+═Cr2O72-(橙色)+H2O逆向移动,则溶液为黄色,故答案为:黄;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,
a.Cr2O72-的浓度不变,为特征定,能判断平衡,故a正确;?
b.Cr2O72-和CrO42-的浓度相同取决于起始浓度和转化,不能判断平衡,故b错误;
c.2v(Cr2O72-)=v(CrO42-),不能判断正逆反应速率关系,不能判断平衡,故c错误;
d.溶液的颜色不变,为特征定,能判断平衡,故d正确;
故答案为:ad;
(3)第②步反应中,Cr元素的化合价降低,则Fe元素的化合价升高,所以为Fe2+,被氧化为Fe3+,故答案为:Fe2+;Fe3+;
(4)A.升高温度平衡逆向移动,化学平衡常数减小,与图象一致,故A正确;
B.pH越大,平衡正向移动的趋势越大,Cr2O72-转化率增大,与图象不符,故B错误;
C.升高温度,反应速率增大,与图象不符,故C错误;
D.Pb2+的浓度越大,平衡正向移动,Cr2O72-的物质的量越小,与图象不符,故D错误;
故答案为:A.
本题解析:
本题难度:一般
2、选择题 金属钾和金属钠的金属性相近,但K比Na略强,当利用金属钠与KCl共熔制金属钾时,发现钾与钠的共熔体难以分离,如调整温度到一定程度,则可利用钠与KCl反应制取K,下面是四种物质的熔沸点:
| K | Na | KCl | NaCl
熔点(℃)
63.6
97.8
770
801?
沸点(℃)
774
882.9
1500
1413?
|