微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某温度下SO2的转化反应(2SO2+O2?2SO3)的平衡常数K=576下面三个混合体系中各物质的浓度如下表:
| 体系 | c(SO2)mol/L | c(O2)mol/L | c(SO3)mol/L | 反应方向
(1)
0.0600
0.400
2.00
(2)
0.0960
0.300
0.500
(3)
0.300
0.0400
1.44
|
试判断各体系中反应进行的方向:
体系(1)______
体系(2)______
体系(3)______.
参考答案:2SO2+O2?2SO3 ,平衡常数K=576
(1)Qc=2.0020.062×0.4=2778>K=576,反应逆向进行;
故答案为:逆反应方向进行;
(2)Qc=0.500020.0962×0.3=231.5<K=576,反应正向进行;
故答案为:正反应方向进行;
(3)Qc=1.4420.32×0.04=576=K,说明费用达到平衡状态;
故答案为:反应已达平衡状态;
本题解析:
本题难度:一般
2、简答题 (1)反应2NO2(g)?N2O4(g)△H<0,在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图1所示.则T1______T2(填“>”、“<”或“=”);增大压强,平衡向______反应方向移动;B、C两点的平衡常数B______C(填“>”或“<”).
(2)反应CO(g)+H2O(g)?H2(g)+CO2(g)△H<0,在800℃时,把等物质的量浓度的CO和H2O(g)充入密闭的反应容器,4min后达到平衡,平衡时c(CO)=0.05mol?L-1,且CO的平衡转化率为50%.请求出该温度下的平衡常数______,并画出H2的物质的量浓度随时间进行的变化图2.
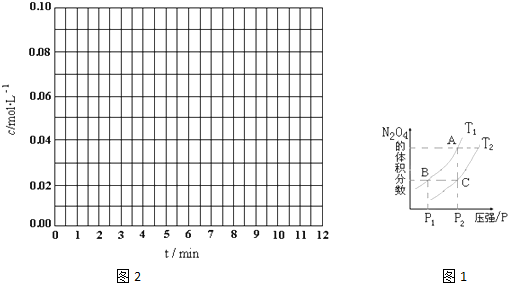
参考答案:(1)因为在压强P2时A点的N2O4体积分数高于C点的N2O4体积分数,又反应2NO2(g)?N2O4(g)△H<0为放热反应.所以A点的温度低,
增大压强平衡想体积减小的一方移动,即向正(或右)反应方向移动,
BC两点的温度分别是T1 T2即B点温度低平衡向右移动K值变大即B点K值大,
故答案为:<;正(或右);>;
(2)设CO变化了xmol/L
CO(g)+H2O(g)?H2(g)+CO2(g)
起始浓度(mol/L)(x+0.05)(x+0.05)00
转化浓度(mol/L)xxxx
平衡浓度(mol/L)0.050.05xx
由x/(x+0.05)×100%=50%解得x=0.05mol
平衡后CO(g)、H2O(g)、H2(g)与CO2(g)的浓度均为,则
K=0.05mol/L×0.05mol/L0.05mol/L×0.05mol/L
=1,
H2的物质的量浓度随时间进行的变化图为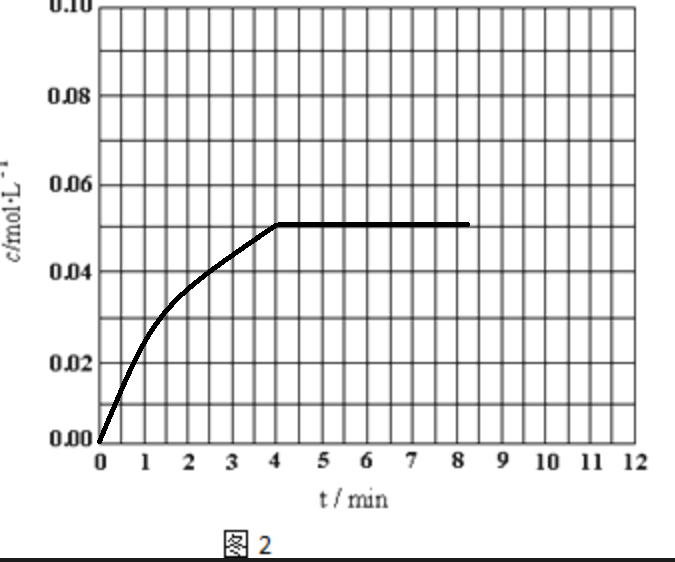 ,
,
故答案为:1; .
.
本题解析:
本题难度:一般
3、选择题 汽车上的催化转化器,可将尾气中的主要污染物转化成无毒物质,反应为:
 在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表
在某温度时.,用气体传感器测得不同时间的NO和CO浓度如表
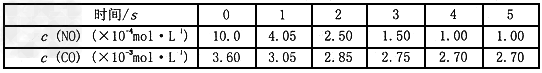
经分析,得出结论不正确的是
[? ]
A. 该反应转化较快,具有存实际意义
B. 催化转化器在冬季时对废气转化效率比夏季更高
C. 2s末的平均反应速率 ?
?
D. 在该温度下,反应的平衡常数K=5000
参考答案:C
本题解析:
本题难度:一般
4、填空题 可逆反应aA(g)+bB(g)

cC(g)+dD(g),试据图Ⅰ、图Ⅱ回答下列问题:
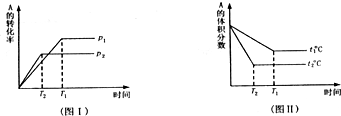
(1)压强p1比p2______(填“大”或“小”)?
(2)(a+b)比(c+d)______(填“大”或“小”)
(3)温度t1比t2______(填“高”或“低”)?
(4)正反应是______热反应.
参考答案:(1)压强越大,反应速率越大,反应达到平衡时用的时间越少,由图Ⅰ可知p1<p2,故答案为:小;
(2)由图Ⅰ可知增大压强A的转化率减小,说明平衡向逆反应方向移动,则)(a+b)<(c+d),故答案为:小;
(3)温度越高反应速率越大,反应达到平衡时用的时间越少,由图Ⅱ可知t1<t2,故答案为:低;
(4)升高温度A的体积分数减小,说明温度升高,平衡向正反应方向移动,说明正反应为吸热反应,故答案为:吸.
本题解析:
本题难度:一般
5、简答题 (1)研究硫及其化合物性质有重要意义.
硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号)
a.容器的压强增大原来的两倍b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式).
(3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______.
(4)加热蒸发下列溶液,能析出得到原溶质的是______.
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸
(5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.
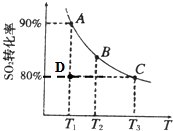
参考答案:(1)温度T1时,平衡点为A,D点二氧化硫转化率小于A,反应向正方向进行,V正>V逆,
转化的二氧化硫的物质的量:2mol×90%=1.8mol
2SO2(g)+O2(g)═2SO3(g)
起始浓度 1mol/L 0.5mol/L 0
转化浓度 0.9mol/L 0.45mol/L 0.9mol/L
平衡浓度 0.1mol/L 0.05mol/L 0.9mol/L K=[SO3]2[SO2]2[O2]=1620L/mol,故答案为:1620L/mol;
T3时,若再向容器中加入2mol SO2、1mol O2,若平衡不移动压强变为原来的2倍,但是该反应前后气体系数不同,加入2mol SO2、1mol O2,相当增大压强平衡向正方向移动,故a错误;达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2,相当于原容器加压,平衡向正反应方向移动,所以放出的热量增大,故Q2>Q1,故b错误;平衡向正反应方向移动,反应物的转化率增大,故c正确;正反应为放热反应,升高温度K减小,故d错误,故选c,
故答案为:>;1620L/mol;c;
(2)根据Mg(OH)2沉淀溶解平衡Mg(OH)2 (s)Mg2+(aq)+2OH- (aq),加入氯化铵,NH4+消耗氢氧根使平衡右移,镁离子浓度增大;故答案为:增大;
氢氧化镁与氟化镁,结构相同,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11,二者氢氧化镁溶解度更小,先沉淀,故答案为:Mg(OH)2;
故答案为:增大;Mg(OH)2;所以溶液显酸性;
(3)Al2(SO4)3是强酸弱碱盐,铝离子水Al3++3H2O Al(OH)3+3H+所以溶液显酸性,加入碳酸氢钠后,碳酸氢根离子发生水HCO3-+H2O H2CO3+OH-,水解生成的氢氧根离子与铝离子水解生成的氢离子反应,双方相互促进,发生双水解,所以有大量气体产生,同时有白色沉淀,
故答案为:Al3++3H2O?Al(OH)3+3H+;铝离子和碳酸氢根离子发生双水解,相互促进,使水解平衡向正方向进行;
(4)a.硝酸钾溶液中不存在水解物质,蒸干水后得到硝酸钾固体,故a正确;
b.AlCl3水解生成氢氧化铝和氯化氢,加热氯化氢易挥发,促进水解平衡向右移动,所以整个该溶液得到的是氢氧化铝固体,故b错误;
c.Al2(SO4)3虽然水解但是生产的硫酸是难挥发性酸,蒸干溶液得到仍然是硫酸铝固体,故c正确;
d.盐酸是挥发性酸,加热促进氯化氢的挥发,蒸干后得不到原溶质,故d错误;
故选ac;
(5)pH=4的氯化铵溶液中,水电离的氢离子浓度:C(H+)=10-4mol/L,pH=4的盐酸溶液中,水电离的氢离子的浓度:C(H+)′=10-10mol/L,C(H+):C(H+)′=106(或 106:1),故答案为:106(或 106:1).
本题解析:
本题难度:一般