| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《化学反应进行的方向》高频考点特训(2017年练习版)(八)
参考答案:B 本题解析:A、根据?H—T?S,若反应为熵减小的反应,温度较高时,可能不能自发进行,故A错误;B、应用盖斯定律,根据容易测量焓变的反应,可计算某些难以直接测量的反应焓变,故B正确;C、根据?H—T?S,若反应△H>0,温度较低时,可能不能自发进行,故C错误;D、根据?H—T?S,△H>0,△S<0的化学反应一定不能自发进行,故D错误。 本题难度:一般 4、选择题 下列有关说法正确的是 |
参考答案:BD
本题解析:A、虽然合金在潮湿的空气中易形成原电池,但并不是所有合金耐腐蚀性都较差,如不锈钢具有较强的抗腐蚀性,错误;B、MgO(s)+C(s)=Mg(s)+CO(g)为气体物质的量增大的熵增加反应,常温下,该反应不能自发进行,则其△H>0,正确;C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,不一定先产生淡黄色沉淀溴化银,还与氯离子和溴离子浓度有关,错误; D、铝离子水解吸热,加热0.1 mol·L-1Al2(SO4)3溶液,铝离子的水解平衡正向移动,水解程度增大、溶液的酸性增强,正确。
考点:考查金属的腐蚀,化学反应方向,沉淀溶解平衡和盐类的水解。
本题难度:一般
5、计算题 在容积为2.0 L的密闭容器中充入0.60 mol X和1.60 mol Y,发生反应:
aX(g)+3Y(g)  ?2Z(g)
?2Z(g)
经过10 min反应达到平衡状态,Y的浓度为0.2 mol/L,Z的物质的量分数为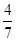 。
。
计算:① 10min内,Z的平均反应速率;
② a 的值;
③ 该条件下X的平衡转化率(百分数表示,保留一位小数);
④该条件下反应2Z(g)  ?aX(g)+3Y(g)的平衡常数。
?aX(g)+3Y(g)的平衡常数。
参考答案:①0.04mol/(L·min)? ②a=1? ③66.7%?④0. 005
本题解析:考查可逆反应的有关计算,一般采用三段式。
aX(g)? +? 3Y(g)? ?2Z(g)
?2Z(g)
起始量(mol)? 0.6? 1.6? 0
转化率(mol)? 0.4a?1.2? 0.8
平衡量(mol)? 0.6-0.4a? 0.4? 0.8
所以有(0.6-0.4a+0.4+0.8)×4/7=0.8
解得a=1
Z的反应速率是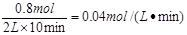
X的转化率是0.4÷0.6×100%=66.7%
平衡时XYZ的浓度分别是0.1mol/L、0.2mol/L、0.4mol/L
所以平衡常数等于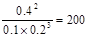
因此其逆反应的平衡常数就是0.005
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《微量元素》.. | |