微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。
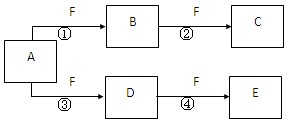
回答下列问题:
(1)Z元素的原子结构示意图为?。
(2)A的电子式为?,组成E的各元素的原子半径由大到小的顺序为?(用元素符号表示)。
(3)写出下列反应的化学方程式:①??③??。
(4)A和E反应生成G,Z2Y是一种麻醉剂,由G在210℃分解生成,该分解反应的化学方程式为?。
(5)常温下,G的水溶液的PH=5,则由水电离的氢离子浓度为?,离子浓度由大到小的关系?。
参考答案:
理科综合试卷·第1页(共16页)
?(1)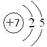 ?(1分)(2)
?(1分)(2)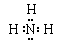 (2分)?N >O> H?(1分)
(2分)?N >O> H?(1分)
(3)①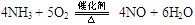 ?
?
③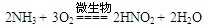 ?(各2分,共4分)
?(各2分,共4分)
(4)? NH4NO3 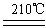 N2O↑ + 2H2O?(2分)
N2O↑ + 2H2O?(2分)
(5)10-5mol/L? c(NO3-)>c(NH4+)>c(H+)>c(OH-) ?(各2分,共4分)
本题解析:A能使湿润红色石蕊试纸变蓝的气体,则A是氨气。D的钠盐是一种致癌物质,则D是亚硝酸,所以X、Y、Z分别是H、O、N。氨气能和氧气反应,所以F是氧气,B是NO,C是NO2,E是硝酸。
(1)氮元素位于第二周期第ⅤA,所以原子结构示意图为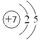 。
。
(2)氨气中含有极性键,电子式为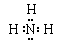 。同周期自左向右原子半径直径减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序是N >O> H 。
。同周期自左向右原子半径直径减小,同主族自上而下原子半径逐渐增大,所以原子半径大小顺序是N >O> H 。
微生物
?(3)①是氨气的催化氧化,方程式为4NH3 + 5O2 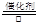 ?4NO + 6H2O。③是氨气被氧化生成亚硝酸,方程式为2NH3 + 3O2 ="===" 2HNO2 + 2H2O 。(4)A和E反应生成G,则G是硝酸铵,Z2Y是N2O,所以分解反应的方程式为 NH4NO3
?4NO + 6H2O。③是氨气被氧化生成亚硝酸,方程式为2NH3 + 3O2 ="===" 2HNO2 + 2H2O 。(4)A和E反应生成G,则G是硝酸铵,Z2Y是N2O,所以分解反应的方程式为 NH4NO3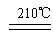 N2O↑ + 2H2O。
N2O↑ + 2H2O。
(5)硝酸铵溶于水水解显酸性,促进水的电离,所以由水电离的氢离子浓度为10-5mol/L。离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
本题难度:一般
2、选择题 下列叙述中正确的是
A.酚类中加入浓溴水一定能产生白色沉淀
B.氮化硅陶瓷属于无机非金属材料
C.浓硝酸存放于带橡胶塞的棕色细口瓶中
D.淀粉和纤维素的分子式都是(C6H10O5)n
参考答案:B
本题解析:A. 不一定会有白色沉淀,酚羟基的邻位和对位没有氢原子可取代时,即是不能被溴取代;B.氮化硅陶瓷从元素的角度属于非金属材料,正确;C.浓硝酸会氧化橡胶,应用玻璃塞,错误;D.淀粉和纤维素不能讲分子式为(C6H10O5)n,因为它们的n值不一样,只能说通式。
本题难度:一般
3、填空题 (10分)三氟化氮是一种无色、无味、无毒且不可燃的气体,可在铜的催化作用下由F2和过量NH3反应得到,在半导体加工,太阳能电池和液晶显示器的制造中得到广泛应用。它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO 和 HNO3,请根据要 求回答下列问题:
求回答下列问题:
⑴写出制备NF3的化学反应方程式:?。反应过程中,氧化剂与还原剂的物质的量之比为?。
⑵写出三氟化氮与水蒸气反应的化学方程式:?。⑶NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体
泄漏时的现象是?。
⑷一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染。其产物除H2O外,还有另三种
钠盐:?(填化学式)。
参考答案:

本题解析:略
本题难度:一般
4、选择题 下列材料最不适宜于储运浓硫酸、浓硝酸的是
A.铁
B.铝
C.陶瓷
D.铜
参考答案:D
本题解析:略
本题难度:一般
5、选择题 同温同压下,在4支相问体积的试管巾分別充有等体积的2种气体,它们是(1 ) NO和 O2 ( 2 ) NO2和 O2 ( 3 ) NO和 NO2 ( 4 )HCl和N2。现将4支试管均倒置于水槽中,充分反应后剩余气体的体积分别是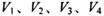 ,则下列关系正确的是
,则下列关系正确的是
A.
B.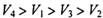
C.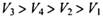
D.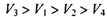
参考答案:C
本题解析:设试管体积均为V,分别根据反应方程式计算:(1)剩余V/8的氧气。(2)剩余3V/8的氧气。(3)为2V/3的NO。(4)余下V/2的氮气。故选C
本题难度:一般