微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 减压过滤装置和普通的过滤装置相比,除可加快过滤速度外,还具有的优点是
A.可过滤胶状沉淀
B.可过滤颗粒更小的沉淀
C.可使沉淀中的杂质减少
D.可得到较干燥的沉淀
参考答案:D
本题解析:减压过滤可加速过滤,并使沉淀抽吸得较干燥,但不宜过滤胶状沉淀和颗粒太小的沉淀,当然并不会改变沉淀中的杂质的量,答案为D
本题难度:一般
2、选择题 下表中实验“操作和现象”与“结论”对应关系正确的一组是
?
| 操作和现象
| 结论
|
A
| 向纯碱中滴加足量浓盐酸,将产生的气体通入苯酚钠溶液,溶液变浑浊
| 酸性:盐酸>碳酸>苯酚
|
B
| 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀
| 该溶液中一定含有大量的SO42-
|
C
| 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化,滴加KSCN溶液,溶液变为红色
| 该Fe(NO3)2试样已经变质
|
D
| 在新制的银氨溶液试管中加入适量葡萄糖溶液,振荡、水浴加热,试管壁附着一层银白色金属
| 葡萄糖是还原性糖
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下面各项中的两个量,其比值一定为2:1的是
A.液面在“0”刻度时,50mL碱式滴定管和25mL碱式滴定管所盛液体的体积
B.相同温度下,0.2mol/L醋酸溶液与0.1mol/L醋酸溶液中的c(H+)
C.常温下,氨水与(NH4)2SO4的混合溶液pH=7时,c(NH4+)与c(SO42-)
D.铜与浓硫酸共热反应中,消耗的Cu与被还原的H2SO4的物质的量
参考答案:C
本题解析:
正确答案:C
A.不正确,滴定管最下端还有一段无刻度;
B.不正确,相同温度下,醋酸溶液浓度越稀,电离程度越大;
C.正确,常温下,氨水与(NH4)2SO4的混合溶液pH=7时,由电荷守恒,c(NH4+)+c(H+)= c(OH― )+2c(SO42-),c(NH4+)=2c(SO42-)
D.不正确,铜与浓硫酸共热反应中,消耗的Cu与被还原的H2SO4的物质的量1:1
本题难度:一般
4、实验题 KMnO4溶液常用作氧化还原反应滴定的标准液其还原产物为Mn2+,由于KMnO4的强氧化性,它的溶液很容易被空气中或水中的某些少量还原性物质还原,生成难溶性物质MnO(OH)2,因此配制KMnO4标准溶液的操作如下所示:
①称取稍多于所需量的KMnO4固体溶于水中,将溶液加热并保持微沸1 h;②用微孔玻璃漏斗过滤除去难溶的MnO(OH)2;③过滤得到KMnO4溶液并贮存;④利用氧化还原滴定方法,在70~80 ℃条件下用基准试剂(纯度高、相对分子质量较大、稳定性较好的物质)溶液标定其浓度。
请回答下列问题:
(1)配制好的KMnO4溶液储存方法是?。准确量取一定体积的KMnO4溶液需要使用的仪器是____________。
(2)在下列物质中,用于标定KMnO4溶液的基准试剂最好选用________(填序号)。
A.H2C2O4·2H2O
B.FeSO4
C.浓盐酸
D.Na2SO3
|
(3)若准确称取W g你选的基准试剂溶于水配成500 mL溶液,取25.00 mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。KMnO4溶液的物质的量浓度为________mol·L-1。滴定终点颜色变化为?。
(4)若用放置两周的KMnO4标准溶液去测定水样中Fe2+的含量,测得的浓度值将________(填“偏高”、“偏低”或“无影响”)。原因是?。KMnO4与Fe2+反应的离子方程式为?。
参考答案:(1) 贮存于棕色试剂瓶并放在暗处?酸式滴定管 (2)A (3) 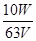 ?溶液由无色变浅红色,且半分钟内不褪色。(4)偏高?空气中还原性物质的作用,使KMnO4溶液的浓度变小,导致计算出来的c(Fe2+)会增大。 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
?溶液由无色变浅红色,且半分钟内不褪色。(4)偏高?空气中还原性物质的作用,使KMnO4溶液的浓度变小,导致计算出来的c(Fe2+)会增大。 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
本题解析:(1) 由于KMnO4受热易分解,所以KMnO4溶液储存方法是贮存于棕色试剂瓶并放在暗处;由于KMnO4溶液具有强氧化性,能腐蚀碱式滴定管下端的橡皮管不能用碱式滴定管量取,应用酸式滴定管量取;(2) 由于FeSO4和Na2SO3在空气中易氧化变质,浓盐酸易挥发,标定标定KMnO4溶液浓度时会引起误差,H2C2O4·2H2O 性质稳定,故选A;(3)H2C2O4和KMnO4溶液反应,H2C2O4被氧化为CO2,KMnO4被还原为Mn2+,依据电子守恒的关系式:5H2C2O4——2KMnO4,将题给数据代入计算可得KMnO4溶液的物质的量浓度为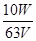 mol·L-1。滴定终点颜色变化为溶液由无色变浅红色,且半分钟内不褪色。(4)KMnO4标准溶液久置,很容易被空气中或水中的某些少量还原性物质还原,而使浓度降低,测定水样中Fe2+的含量,测得的浓度值将偏高;高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为锰离子,发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
mol·L-1。滴定终点颜色变化为溶液由无色变浅红色,且半分钟内不褪色。(4)KMnO4标准溶液久置,很容易被空气中或水中的某些少量还原性物质还原,而使浓度降低,测定水样中Fe2+的含量,测得的浓度值将偏高;高锰酸钾在酸性溶液中具有强氧化性能氧化亚铁离子为铁离子,本身被还原为锰离子,发生的离子反应为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
本题难度:一般
5、选择题 某学生做完实验以后,采取以下方法分别清洗所用仪器:
①用浓氨水清洗做过银镜反应的试管;
②用酒精清洗做过碘升华实验的烧杯;
③用浓盐酸清洗做过KMnO4分解实验的试管;
④用盐酸清洗长期存放过FeCl3溶液的试剂瓶;
⑤用NaOH溶液清洗盛过苯酚的试管。你认为他的操作
A.①不对
B.③④不对
C.④⑤不对
D.全部正确
参考答案:A
本题解析:①中残留物为Ag,它不溶于氨水,常用稀HNO3除去;②中残留物为I2,它易溶于酒精,可用酒精洗去;③中残留物为K2MnO4和MnO2,其中K2MnO4用水即可洗去,但MnO2难溶于水,可利用其与浓盐酸反应生成易溶于水的MnCl2而洗去;④中残留物主要为Fe(OH)3,能用盐酸洗去;⑤中利用苯酚的酸性使其转化为易溶于水的苯酚钠而洗去。
本题难度:简单