微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、推断题 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。

(1)写出B原子的电子排布式________。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点____(填“高”或“低”),其原因是_____________________。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点________(填“高”或“低”),其原因是____________________。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为________,简要描述该配合物中化学键的成键情况______________________。
参考答案:(1)1s22s22p63s23p4
(2)高;因为A的氢化物存在氢键
(3)低;晶体类型不同
(4)[Cu(NH3)4]SO4;中心原子与配位体之间以配位键相结合,内界与外界之间以离子键相结合
本题解析:
本题难度:一般
2、填空题 为验证干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性,肖飞同学设计了如下实验。(其中a是有色布条)
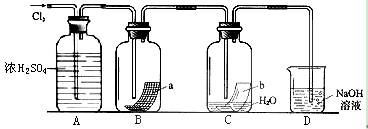
⑴ A中浓硫酸的作用是 ??。
⑵ 实验中观察到的现象是 ??,
可以得出的结论是 ?_____。
⑶ D装置的作用是 ??,其中发生的化学反应方程式是 ?______________________________________________
参考答案:⑴ 干燥氯气
⑵B中的有色布条不退色,C中的有色布条退色。
干燥的Cl2没有漂白性,而Cl2与水反应后的产物具有漂白性。
⑶ 吸收尾气 ,Cl2+2NaOH=NaCl+NaClO+H2O
本题解析:略
本题难度:简单
3、填空题 W、X、Y、Z是原子序数依次增大的同一短同期的元素,W、X是金属元素,Y、Z是非金属元素。回答下列问题:
(1)W、X对应的最高价氧化物的水化物可以反应生成盐和水,该反应的离子方程式为_____________。
(2)X的硝酸盐的水溶液显____性,用离子方程式解释原因________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________________。
(4)W、X、Y、Z四种元素的简单离子的半径由大到小的顺序是:____>____>____>_____。(填离子符号)
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量的水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式_________________ 。
参考答案:(1) Al(OH)3 +OH- == AlO2- +2H2O
(2)酸;Al3++3H2O 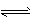 Al(OH)3 +3H+
Al(OH)3 +3H+
(3)SO2+Cl2+2H2O==H2SO4+2HCl
(4)S2->Cl->Na+>Al3+
(5) Cl2O7(1)+H2O(I)==2HClO4 (aq);△H=-4Q kJ/mol
本题解析:
本题难度:一般
4、选择题 关于卤素的下列叙述中正确的是
[? ]
A.卤素是典型的非金属元素,因此不能与其它非金属元素化合
B.卤素单质越活泼,其熔、沸点越高
C.卤素各单质都能和水剧烈反应
D.卤素单质都能与H2化合
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列大小比较正确的是( )
A.稳定性:HI>HBr>HCl>HF
B.元素非金属性:Si>P>S>Cl
C.沸点:正丁烷>异丁烷>丙烷
D.碱性:NaOH>KOH>Ca(OH)2>Ba(OH)2
参考答案:A、同主族元素,自上而下非金属性减弱,所以非金属性F>Cl>Br>I,氢化物稳定性HF>HCl>HBr>HI,故A错误;
B、同周期随原子序数增大,金属性减弱,非金属性增强,所以非金属性Si<P<S<Cl,故B错误;
C、分子晶体中,相对分子质量越大,沸点越高,烷烃同分异构体中支链越多,沸点越低,相对分子质量正丁烷=异丁烷>丙烷,但异丁烷支链多,所以沸点低,即沸点为正丁烷>异丁烷>丙烷,故C正确;
D、根据元素周期律可知金属性K>Na,Ba>Ca,所以碱性KOH>NaOH,Ba(OH)2>Ca(OH)2,故D错误.
故选C.
本题解析:
本题难度:简单