微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各项中表达正确的是( )
A.F-的结构示意图:

B.CO2的分子模型示意图:
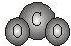
C.NaCl的电子式:
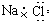
D.N2的结构式::N≡N:
参考答案:A、F-核外电子数为10,故A正确;
B、二氧化碳为直线形分子,故B错误;
C、离子化合物电子式书写,简单阳离子用离子符号表示,阴离子要加括号,并写上离子所带电荷,故C错误;
D、N2的电子式应去掉孤对电子,故D错误;
故选A.
本题解析:
本题难度:简单
2、填空题 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B、D同周期,C、D同主族,A的原子结构示意图如图,B、C可形成离子化合物B2C3,据此填空:
(1)C的元素名称为______,其氢化物的电子式为______.
(2)C、D两种元素形成的氢化物稳定性强弱为______.(填化学式)
(3)B和D的最高价氧化物的水化物化学式分别为______和______.两者反应的离子方程式为______.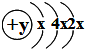
参考答案:由A的原子结构示意图为
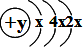
,据核外电子排布规律x仍为2,y=14,A为硅,A与B同周期,原子序数A>B,B和C可形成离子化合物B3C2,可推知B的化合价为+3,应为铝,C为氧,D和C同主族,均为短周期元素,则D为硫,由此得到B为B为Al,C为O,D为S.
(1)C为氧元素,其氢化物为H2O,电子式为
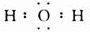
,故答案为:氧;
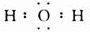
;
(2)C、D两种元素形成的氢化物分别为H2O、H2S,由于非金属性O>S,则稳定性H2O>H2S,故答案为:H2O>H2S;
(3)B为Al,对应的最高价氧化物的水化物为Al(OH)3,D为S元素,对应的最高价氧化物的水化物为H2SO4,两者反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3;H2SO4;Al(OH)3+3H+=Al3++3H2O.
本题解析:
本题难度:简单
3、选择题 同主族元素形成的同一类型化合物,往往其结构和性质相似。PH4I是一种白色晶体,下列对PH4I的叙述中,正确的是
[? ]
A.它是一种共价化合物
B.它既含离子键又含共价键
C.它不可能与NaOH溶液反应
D.它受热时不会分解
参考答案:B
本题解析:
本题难度:一般
4、选择题 固体熔化时,必须破坏非极性共价键的是
[? ]
A.冰
B.晶体硅
C.溴
D.二氧化硅
参考答案:B
本题解析:
本题难度:简单
5、选择题 如表为元素周期表前四周期的一部分,下列有关X、W、Y、R、Z五种元素的叙述中,正确的是( )
A.Y元素最高价氧化物对应水化物的酸性比W元素的弱
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物比X的氢化物稳定
D.常温常压下,五种元素的单质中有两种是气态