微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将下列物质的量浓度相等的溶液等体积两两混合有白色沉淀生成,加入过量的稀硝酸后,沉淀消失并放出气体,再加入硝酸银溶液又有白色沉淀生成的是
A.Na2CO3和Ca(OH)2
B.Na2CO3和CaCl2
C.Ca(HCO3)2和NaOH
D.Na2SO4和Ba(NO3)2
参考答案:B
本题解析:A、Na2CO3和Ca(OH)2等浓度等体积混合产生白色沉淀,Ca2++CO32-=CaCO3↓,加入过量硝酸发生反应,OH-+H+=H2O;CaCO3+2H+=CO2↑+H2O+Ca2+;再加入AgNO3溶液无白色沉淀生成,故A不符合;? B、Na2CO3和CaCl2再加入AgNO3溶液,Ag++Cl-=AgCl↓,有白色沉淀生成,故B符合;?
C、Ca(HCO3)2和NaOH等浓度等体积混合产生白色沉淀,Ca2++HCO3-+OH-=CaCO3↓+H2O,加入过量硝酸发生反应,CaCO3+2H+=CO2↑+H2O+Ca2+,但是加入AgNO3溶液无白色沉淀产生;故C不符合;
D、Na2SO4和Ba(NO3)2等浓度等体积混合产生白色沉淀,Ba2++SO42-=BaSO4↓,加入过量硝酸不发生反应,无沉淀消失和气体生成,故D不符合;
点评:本题有一个突破点在于稀硝酸体系中出现沉淀,则可以排除A、C选项,再根据有气体生成可以得正确选项。
本题难度:简单
2、选择题 以下关于纸层析的叙述,错误的是
A.纸层析法适用于分离和检验化学性质十分相近的分子或离子
B.用纸层析法可以检验氯化铁溶液中是否混有少量氯化铜
C.纸层析法是利用试样中各种离子随展开剂在滤纸上展开的速率不同而形成不同位置的色斑
D.为了看到色斑,只有有色离子的检验才可以用纸层析法
参考答案:D
本题解析:纸层析法又称纸色谱法。以纸为载体的色谱法。固定相一般为纸纤维上吸附的水分,流动相为不与水相溶的有机溶剂;也可使纸吸留其他物质作为固定相,如缓冲液,甲酰胺等。将试样点在纸条的一端,然后在密闭的槽中用适宜溶剂进行展开。当组分移动一定距离后,各组分移动距离不同,最后形成互相分离的斑点。所以不一定是有色离子才可以使用纸层析法。答案选D。
本题难度:一般
3、选择题 下列说法正确的是
A.H2的摩尔质量是2g
B.1mol氧的质量是16g
C.氧气的摩尔质量是32g/mol
D.2g H2含1molH
参考答案:C
本题解析:摩尔质量的单位是g/mol,A不正确,C正确。用摩尔表示物质时应该用化学式来表示,1mol氧就属于指代不明确的,氧可能是氧原子也可能是氧分子,B不正确。氢气是双原子分子,2g H2含有2molH,D不正确。答案选C。
本题难度:简单
4、简答题 小刚同学用MnO2和浓HCl制氯气(反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O)并设计如下实验装置用于制取纯净的无水氯化铜.回答有关问题:

(1)装置B的作用是______,装置C的作用是______.
(2)装置D中发生反应的化学方程式为______.
(3)装置E的作用是______.
(4)装置A中,如果反应产生氯气的体积为2.24L(标况),则反应中被氧化的HCl的物质的量为______.
(5)工业上将氯气通入石灰乳可制取漂白粉,化学反应方程式为______.
(6)工业制取漂白粉的氯气可通过电解饱和食盐水得到.在电解食盐水之前,需要提纯食盐水.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作,正确的操作顺序是______.
①过滤?②加过量的NaOH溶液?③加适量的盐酸?④加过量的Na2CO3溶液?⑤加过量的BaCl2溶液
A、①④②⑤③B、④①②⑤③C、②⑤④①③D、⑤②④③①
参考答案:(1)实验室制备氯气中含有氯化氢和水蒸气,需要用饱和食盐水除去氯化氢,浓硫酸干燥氯气;
故答案为:除去Cl2中混有的HCl,除去Cl2中混有的水蒸气;
(2)装置D中是干燥的氯气和铜加热发生的反应,发生反应的化学方程式为:Cu+Cl2?△?.?CuCl2;
故答案为:Cu+Cl2?△?.?CuCl2;
(2)氯气有毒污染空气,不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:吸收多余的Cl2,防止污染空气;
(3)装置A中,如果反应产生氯气的体积为2.24L(标况)物质的量为0.1mol,则反应中被氧化的HCl的物质的量为0.2mol;
故答案为:0.2mol;
(5)氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,反应的化学方程式为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
故答案为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
(6)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:②加过量的氢氧化钠溶液 ⑤加过量的氯化钡溶液 ④加过量的碳酸钠溶液 ①过滤 ③加适量盐酸;②⑤可互换;
故答案为:C;
本题解析:
本题难度:一般
5、选择题 将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是?
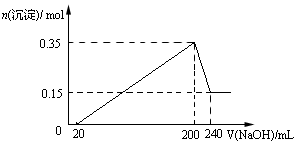
A.Mg和Al的总质量为9g
B.最初20mLNaOH溶液用于中和过量的稀硫酸
C.NaOH溶液物质的量浓度为5mol·L-1
D.生成的氢气在标准状况下的体积为11.2L
参考答案:D
本题解析:试题分析:根据图像可知,加入氢氧化钠溶液后并没有立即生成沉淀,这说明稀硫酸是过量的,所以应该有关的方程式是H++OH-=H2O、Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓、Al(OH)3+OH-=AlO2-+2H2O。根据图像可知,和氢氧化铝反应的氢氧化钠溶液是240ml-200ml=40ml,则氢氧化铝的物质的量是0.35mol-0.15mol=0.20mol,氢氧化镁是0.15mol,所以根据原子守恒可知,镁和铝的总的质量是0.15mol×24g/mol+0.2mol×27g/mol=9g;氢氧化钠溶液的物质的量浓度是0.2mol÷0.04L=5mol/L。生成的氢气在标准状况下的体积为(0.15mol+0.3mol)×22.4L/mol=10.08L,所以选项D是错误的,答案选D。
考点:考查镁、铝和酸碱反应的有关计算
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是明确反应原理,然后依据方程式和图像灵活运用即可。
本题难度:一般