|
高中化学知识点总结《反应速率与平衡的有关计算》高频试题预测(2017年最新版)(六)
2017-08-22 15:46:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)(1)在一密闭容器中充入1molNO2,建立如下平衡:2NO2 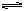 ?N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___?_。 ?N2O4,测得NO2的转化率为a%,在其它条件不变的情况下,再充入1molNO2,待新平衡建立时,又测得NO2的转化率为b%。试问a、b值的大小关系为___?_。
(2)汽车尾气中的主要污染物有CO、NOx,CO分析仪是以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是?。

A.负极的电极反应式为:CO+O2—―2e-=CO2
B.工作时电极b作正极,O2-由电极a流向电极b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,说明汽车尾气中CO的含量越高
| (3)阿波罗宇宙飞船上使用的是氢氧燃料电池,试回答下列问题:
①若电解质溶液为KOH溶液,构成燃料电池,则负极反应式为____________?____,
②如把KOH改为稀H2SO4作电解质,则正极反应式为_____?___________,
③如把H2改为甲烷,KOH作电解质,则负极反应式为?
参考答案:(1)b>a?(2)B? (3)? ①2H2+4OH--4e-===4H2O? ②?O2+4H++4e-===2H2O ③ CH4-8e-+10 OH-=CO32-+7 H2O
本题解析:(1)由于反应物和生成物都是一种,所以再通入NO2相当于增大压强,平衡向正反应方向移动,转化率增大。原电池中阳离子向正极移动,阴离子向负极移动。根据装置图可判断,a是负极,CO被氧化。b是正极,氧气被还原。所以选项B是错误的。(3)负极失去电子,所以氢气通入负极,氧气通入正极。若用甲醇作燃料,则甲醇在负极失去电子,由于溶液是氢氧化钾溶液,所以生成物是碳酸钾和水。
本题难度:一般
2、计算题 对于CO(g)+H2O(g) CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。 CO2(g)+H2(g),起始时只有CO、H2O(g)且浓度都是4 mol·L-1,达到平衡时,CO的浓度为1 mol·L-1;将H2O(g)的浓度提高到3 mol·L-1,平衡时CO的浓度为0.53 mol ·L-1。求:两次平衡时CO、H2O的转化率和CO2在平衡混合物中百分含量。
参考答案:CO转化率=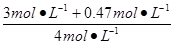 ×100%=86.75%, ×100%=86.75%,
H2O(g)转化率= ×100%=57.8%, ×100%=57.8%,
w(CO2)=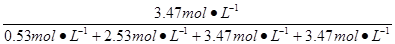 ×100%=34.7%。 ×100%=34.7%。
。
本题解析:第一次平衡过程:CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g)
起始浓度/mol·L-1? 4? 4? 0? 0
转化浓度/mol·L-1? 3? 3? 3? 3
平衡浓度/mol·L-1? 1? 1? 3? 3
CO转化率=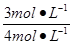 ×100%=75%, ×100%=75%,
H2O(g)转化率=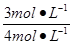 ×100%=75%, ×100%=75%,
w(CO2)=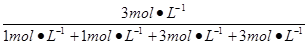 ×100%=37.5%。 ×100%=37.5%。
第二次平衡过程:
CO(g)+H2O(g) CO2(g)+H2(g) CO2(g)+H2(g)
起始浓度/mol·L-1? 1? 3? 3? 3
转化浓度/mol·L-1? 0.47? 0.47? 0.47? 0.47
平衡浓度/mol·L-1? 0.53? 2.53? 3.47? 3.47
CO转化率=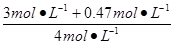 ×100%=86.75%, ×100%=86.75%,
H2O(g)转化率= ×100%=57.8%, ×100%=57.8%,
w(CO2)=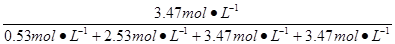 ×100%=34.7%。 ×100%=34.7%。
本题难度:简单
3、填空题 有a、b两个等体积且极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等。在相同条件下将3mol?A,1mol?B分别同时混合于a、b两容器中,发生反应:3A(g)+B(g) ?2C(g)+D(g) ?2C(g)+D(g)
(1)达到平衡时,a中A的浓度为M?mol/L。A的转化率为N,b中A的浓度为m?mol/L,A的转化率为n,则M____m;N_____n(填>、<、=、无法比较)
(2)保持温度不变,按下列配比分别充入a、b两容器,达平衡后,a中A的浓度为M?mol·L-1的是____________?
A?6mol?A+2mol?B?
B?3mol?A+2mol?C?
C?2mol?C+1mol?B+1mol?D
D?2mol?C+1mol?D?
E?1.5mol?C+0.5mol?B+1mol?C+0.5mol?D
参考答案:(1)<?; <?
(2)D、E
本题解析:
本题难度:一般
4、选择题 500℃条件下,在恒容密闭容器中,充入1molNO2后达到如下平衡2NO2(g) N2O4(g)?,平衡后,向容器内再充入1mol N2O4(g),下列说法正确的(?) N2O4(g)?,平衡后,向容器内再充入1mol N2O4(g),下列说法正确的(?)
A.容器内气体颜色先变浅后变深,最后比原来还要浅
B.反应向逆反应方向移动,所以NO2的百分含量增大
C.容器中的气体密度始终不变
D.N2O4的体积分数增大
参考答案:D
本题解析::
A 在恒容容器内气体颜色变化与有色气体的浓度有关,由c=n/v可知充入无色气体N2O4时由于NO2的浓度此刻没有变化,颜色不变,而后随着可逆反应的向正反应方向的进行,NO2浓度减小,再次达到平衡时气体颜色变浅。
B 在该反应条件下,充入N2O4相当于多体系增大压强,平衡向气体分子数减小的方向移动。
C 容器内气体的密度ρ="m/v" 充入N2O4增大了容器内气体的质量,使气体密度增大。
D 充入N2O4 ?平衡向正方向移动,使体系内N2O4的浓度增大,同样增大了其体积分数。
本题难度:一般
5、计算题 在一定条件下,将物质的量之比为1∶3的N2和H2?102g通入密闭容器中,达到平衡后,测知混合气体的平均相对分子质量为12.5。求混合气体中NH3的质量?
参考答案:32.64g
本题解析:设N2的物质的量为x,则H2的物质的量是3x,由题意知,28g/mol×x+2g/mol×3x=102g,解之,得:x=3mol。又由:
N2(g)+3H2(g) 2NH3(g) 2NH3(g)
n(开始)/mol: 3? 9? 0
n(转化)/mol:? a? 3a? 2a?
n(平衡)/mol: 3-a? 9-3a?2a
(3-a)+(9-3a)+2a= =8.16mol =8.16mol
解之,得:a=1.92mol。
则混合气体中NH3的质量为:2×1.92mol×17g/mol=32.64
本题难度:简单
|