微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列与金属腐蚀有关的说法正确的是( )
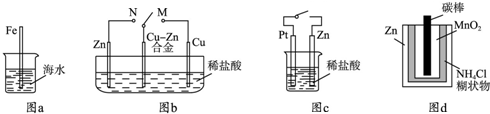
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
参考答案:A.图a中,铁棒发生化学腐蚀,靠近底端的部分与氧气接触少,腐蚀程度较轻,故A错误;
B图b中开关由M置于N,Cu-Zn作正极,腐蚀速率减小,故B正确;
C.图c中接通开关时Zn作负极,腐蚀速率增大,但氢气在Pt上放出,故C错误;
D.图d中干电池放电时MnO2发生还原反应,体现锌的还原性,故D错误.
故选B.
本题解析:
本题难度:简单
2、填空题 如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:
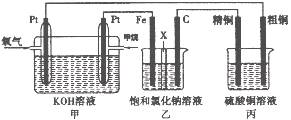
(1)甲烷燃料电池负极电极反应式是:?
(2)石墨电极(C)的电极反应式为?
(3)若在标准状况下,有2. 24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为_?L;丙装置中阴极析出铜的质量为?g
(4)某同学利甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。若用于制漂白液时a为电池_?极,电解质溶液最好用_?。若用于制 ?Fe(OH)2,使用硫酸钠做电解质溶液,阳极选用?作电极。

参考答案:(1)CH4-8e-+10OH-=CO32-+7H2O
(2)2Cl--2e-=Cl2↑
(3)4.48? 12.8
(4)负?饱和氯化钠溶液或食盐水?铁
本题解析:甲为燃料电池,甲烷通入一极为负极,氧气通入一极为正极;乙为电解池,Fe为阴极,C为阳极,实质为电解饱和食盐水;丙为电解池,粗铜为阳极,精铜为阴极,实质为精炼铜。
(1)注意在碱性环境中进行的电极反应产物为CO32-;
(2)石墨电极(C)的电极为阳极,阴离子放电;
(3)标准状况下,2.24L氧气的物质的量为0.1mol,参与反应转移电子数为0.4mol ;铁电极为阴极,阳离子放电:2H++2e-=H2,则放出氢气0.2mol,即为4.48L;丙装置中阴极反应式为:Cu2++2e-=Cu,则析出铜0.2mol,即为12.8g。
(4)用于制漂白液时利用电解饱和氯化钠溶液或食盐水,同时利用生成的NaOH溶液吸收生成的Cl2进而生成漂白液,因此Cl2要在B极生成才可被NaOH溶液吸收完全。?用于制Fe(OH)2时需要铁做阳极放电生成亚铁离子:Fe-2e-=Fe2+
本题难度:一般
3、填空题 (6分)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。
在空气酸度不大的环境中,其负极是?,负极反应式为?;
正极是?,正极反应式为?。
参考答案:(6分)?铁(或Fe);2Fe = 2Fe2++4e-;碳(或C);O2 + 2H2O+ 4e-= 4OH-
本题解析:考查钢铁的电化学腐蚀。
在钢铁的电化学腐蚀中,钢铁中的碳是正极,铁是负极,失去电子,发生氧化反应,电极反应式是2Fe = 2Fe2++4e-;如果空气的酸度不大,则发生的是吸氧腐蚀,正极电极反应式是O2 + 2H2O+ 4e-= 4OH-。
本题难度:简单
4、填空题 某实验小组依据甲醇燃烧的反应原理,设计如图所示的装置。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。请回答:
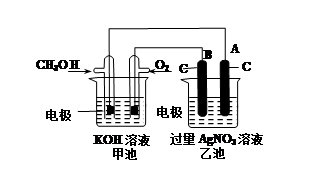
①通入O2的电极名称是?,B电极的名称是?。
②通入CH3OH的电极的电极反应式是?,A电极的电极反应式为?。
③乙池体积为1L,在AgNO3足量的情况下电解一段时间后溶液的PH变为1,则在这段时间内转移的电子数目为??
参考答案:①正?阳?(各1分)?
②CH3OH+8OH-+6e-=CO32-+6H2O(2分)? Ag++ e-=Ag(2分)
③0.1NA(2分)
本题解析:这是一个燃料电池,燃料电池中燃料总是电池的负极,氧气一定是电池的正极,在乙池中,是一个电解池,连接电池正极的是电解池的阳极,连接电池负极的是电解池的阴极,电解硝酸银溶液,电极材料都是惰性电极,阳极上是阴离子氢氧根离子放电,阴极上是银离子放电。在乙池中,电极反应为:阳极:4OH——4e-=O2↑+2H2O,当溶液的PH变为1时,溶液中的c(H+)=0.1mol/L那么n(H+)=0.1mol,也就是说,消耗掉的氢氧根就是0.1mol,那么从电极方程式中可以看出,在这段时间内转移的电子物质的量为0.1mol,电子数目为0.1NA。
本题难度:一般
5、选择题 [双选题]烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的
CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
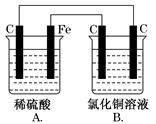
A.A为原电池,B为电解池
B.A为电解池,B为原电池
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.一段时间后,B烧杯中溶液的浓度增大
参考答案:BD
本题解析:由A、B两装置可知,A为原电池,B为电解池。A、B两池产生气体关系为:H2~Cl2~2e-,故n(H2)=n(Cl2),电解CuCl2溶液的反应式为CuCl2 ?Cu+Cl2↑,故浓度减小。
?Cu+Cl2↑,故浓度减小。
本题难度:一般