微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知某化学反应的平衡常数表达式为K=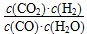 ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 1.67
| 1.11
| 1.00
| 0.60
| 0.38
|
下列有关叙述不正确的是
A.该反应的化学方程式是:CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO2和H2各1 mol,5 min后温度升高到830 ℃,此时测得CO为0.4 mol时,该反应为平衡状态
D.某温度下,如果平衡浓度符合下列关系式: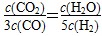 ,判断此时的温度是1000 ℃
,判断此时的温度是1000 ℃
2、选择题 已知可逆反应:A(s)+2B(g) C(g)+D(g)?△H<0。在一定温度下将1mol A和2molB加入如右图所示甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
C(g)+D(g)?△H<0。在一定温度下将1mol A和2molB加入如右图所示甲容器中,将2 molC和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,在恒温下使两容器内反应均达到平衡状态(如图所示,隔板K不能移动)。下列说法正确的是
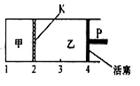
A.保持乙中压强不变,升高温度,达到新的平衡后,乙中平均相对分子质量增大
B.保持温度和乙中压强不变,向乙中再加入2 mol D,达到新平衡后,一定有c(B)乙>c(B)甲
C.若该温度下反应的K=1,则甲中B和乙中C的转化率均为66.7%
D.保持温度和活塞位置不变,甲中再加入1 mol A和2mol B,达到新的平衡后,c(B)甲=2c(B)乙
3、实验题 (共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g) H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
t/min
| 0
| 2
| 4
| 6
| 8
| 10
|
n(HI)/mol
| 0.180
| 0.164
| 0.152
| 0.144
| 0.140
| 0.140
|
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为?。达平衡时,HI的转化率是_________。(2)上述正向反应是:?反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向?反应方向移动(填“正”或“逆”),正反应速率?(填“增大”、“减小”或“不变”),容器内混合气体的压强?(填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K的值为?。
2HI(g)的平衡常数K的值为?。
(5)要增大反应2HI(g) H2(g)+I2(g)的平衡常数,可采取的措施是?(选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是?(选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂?
D.升高温度
4、选择题 在高温下,反应2HBr(气)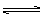 H2(气)+Br2(气)-Q达到平衡时,要使混合气体颜色加深,可采用的方法是?
H2(气)+Br2(气)-Q达到平衡时,要使混合气体颜色加深,可采用的方法是?
A.减小压强
B.缩小体积
C.升高温度
D.增大[H2]
5、选择题 在373K 时,把0.5 mol N2O4气体通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2 s时,NO2的浓度为0.02 mol/L。在60 s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法正确的是(?)
A.在2 s时,体系内压强为反应前的1.1倍
B.前2 s,以N2O4浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
C.平衡时,体系内含N2O4 0.25 mol
D.平衡时,若往容器内充入氮气,则可提高N2O4的转化率