|
高考化学知识点总结《影响化学反应速率的因素》高频试题预测(2017年最新版)(八)
2017-08-22 15:57:26
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 决定化学反应速率的主要因素是
A.催化剂
B.参加反应的物质本身的性质
C.反应物的浓度
D.温度、压强以及反应物的接触面
|
参考答案:B
本题解析:反应物物质本身的性质对化学反应速率的影响,起到决定性的作用,因此答案选B
考点:考查影响化学反应速率因素的相关知识点
本题难度:一般
2、选择题 过量的两份锌粉a和b,分别加入等量的稀硫酸中,并向a中加入少量CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系正确的是(?)?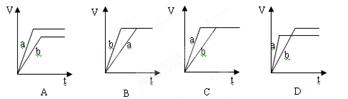
参考答案:C
本题解析:锌能和硫酸铜反应置换出铜,从而构成铜锌原电池,加快反应速率,即a中曲线的斜率大。由于锌是过量的,则生成的氢气是等量的,所以选项C正确,答案选C。
点评:该题是中等难度的试题,主要是考查学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑推理能力。该题的关键是明确外界条件是如何影响反应速率的,如何结合图像灵活运用即可。
本题难度:一般
3、选择题 对于可逆反应:aA(g)+bB(g)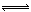 mC(g)+? nD(g);△H<0,下列说法正确的是 mC(g)+? nD(g);△H<0,下列说法正确的是
A.浓度改变平衡必移动
B.增大压强平衡必移动
C.升高温度平衡必移动
D.导入氦气平衡必移动
参考答案:C
本题解析:如果反应前后气体的体积不变,则通过改变压强改变浓度平衡不移动,因此选项A和B均不正确;正方应是放热反应,升高温度平衡一定向逆反应方向移动,C正确;如果容器的容积不变或反应前后气体的体积不变,则通入氦气平衡不移动,D不正确,答案选C。
本题难度:一般
4、填空题 下表是某兴趣小组通过实验获得的稀硫酸与某金属反应的实验数据
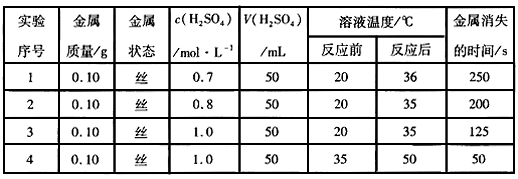
分析上述数据,回答下列问题:
(1)上述反应中,反应物的总能量比生成物的总能量____________(选填“高”、“低”或“相等”)。
(2)实验1、2可得出的结论是__________________;实验3、4可得出的结论是___________________。
(3)若将该金属与铁用导线连接,插入盛有稀硫酸的烧杯中制作成原电池,观察到铁的表面有大量气泡。该金属的金属活动性比铁________(选填“强”或“弱”),铁在该原电池中作__________极。
参考答案:(1)高
(2)反应物浓度越大,反应速率越快;反应温度越高,反应速率越快
(3)强;正
本题解析:
本题难度:一般
5、选择题 下列各表述与示意图一致的是( )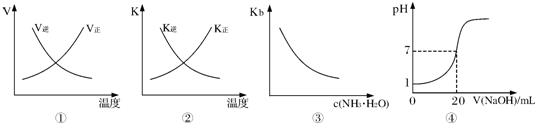
A.图①表示反应N2(g)+O2(g)?2NO(g)△H>0正、逆反应的速率随温度的变化
B.图②表示反应N2(g)+3H2(g)?2NH3(g)△H<0正、逆反应的平衡常数随温度的变化
C.图③表示氨水的电离平衡常数随氨水浓度c(NH3?H2O)的变化
D.图④表示25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,溶液的pH随加入碱体积的变化
参考答案:A、该反应为吸热反应,温度升高,正逆反应速率都增大,平衡向着正向移动,所以正反应速率大于逆反应速率,而图象中达到平衡后升高温度,逆反应速率减小是错误的,逆反应速率也应该增大,故A错误;
B、该反应为放热反应,升高温度后平衡向着逆向移动,所以逆反应的平衡常数增大,正反应的平衡常数减小,而图象中达到平衡后升高温度,逆反应的平衡常数减小、正反应的平衡常数增大与实际不相符,故B错误;
C、氨水的电离平衡常数与浓度没有关系,只受温度的影响,所以温度不变,电离平衡常数不变,而图象中平衡常数随着氨水的浓度增大而减小是错误的,故C错误;
D、25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,滴定前盐酸的pH=1,随着氢氧化钠体积不断增大,溶液的pH逐渐增大,当加入20mL氢氧化钠溶液时,二者恰好反应,溶液的pH=7,该图象符合反应实际,故D正确;
故选D.
本题解析:
本题难度:一般
|