微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 pH=4的NH4Cl溶液和pH=10的Na2CO3溶液中,水的电离度分别为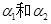 ,则它们的大小关系是
,则它们的大小关系是
A.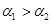
B.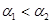
C.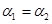
D.无法判断
参考答案:C
本题解析:pH=4的NH4Cl是强酸弱碱盐,水电离的OH-大部分被NH4+消耗生成NH3.H2O,只有
少量水电离的OH-剩余,形成溶液的OH-, 而水电离的H+积累形成溶液的H+,即
[H+]水=[H+]溶液=10-4;而pH=10的Na2CO3是强碱弱酸盐,水电离的H+大部分被CO32-消耗生成HCO3-、H2CO3,只有少量水电离的H+剩余,形成溶液的H+,而水电离的OH-积累形成溶液的OH-,即[OH-]水=[OH-]溶液,又因为[H+]溶液=10-10,所以,[OH-]溶液=10-4,即[OH-]水=10-4。又因为[H+]水=[OH-]水,所以,两者水的解离度相等。
点评:本题考查盐对水电离的影响,在对水电离因素的影响中,要重点掌握酸碱抑制水的电
离,盐要具体问题具体分析。
本题难度:简单
2、选择题 某一密闭绝热容器中盛有饱和Ca(OH)2溶液,当加入少量CaO粉末,下列说法正确的是?
①有晶体析出 ②c[Ca(OH)2]增大 ?③pH不变
④c(H+)·c(OH)-的积不变⑤c(H+)一定增大
A.①
B.①⑤
C.①②④
D.①③
参考答案:B
本题解析:氧化钙能和水反应生成氢氧化钙,同时放热。由于氢氧化钙是饱和溶液,且氢氧化钙的溶解度随温度的升高而降低,所以溶液中会析出晶体。溶解度降低,浓度减小,因此碱性降低,所以氢离子浓度增大答案选B。
本题难度:简单
3、填空题 (6分)已知:相同温度时,一元弱酸HA的Ka比一元弱酸HB的Ka大。试比较相同温度相同体积的下列两溶液中离子数目的多少。(填“=”、“ >”、“<”、“无法确定”)
(1)物质的量浓度相等的NaA溶液(n1)与NaB溶液(n2),n1?n2
(2)pH相等的NaA溶液(n1)与NaB溶液(n2),n1? n2
n2
(3)c(A—)与c(B—)相等的NaA溶液(n1)与NaB溶液(n2),n1?n2
参考答案:
(1)>(2)>(3)<
本题解析:略
本题难度:简单
4、选择题 常温下将浓度均为0.1 mol / L的CH3COOH和CH3COONa两溶液等体积混合,混合溶液的pH<7,有关叙述正确的是(?)
A.c(CH3COOH)+c(CH3COO-)=0.2 mol·L-1
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.向混合后的溶液中滴入NaOH溶液至pH=7,则有c(Na+)=c(CH3COO—)
D.混合溶液加水稀释,c(OH— )减小
参考答案:C
本题解析:A:物料守恒:c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1 (设溶液体积可以相加)
B:溶液呈酸性,c(OH-)<c(H+) 排除
C:pH=7,则c(OH-)>c(H+),再由电荷守恒c(Na+)+c(H+) =c(CH3COO-)+c(OH-)可推知c(Na+)=c(CH3COO—),正确
D:加水稀释则酸性减弱,c(H+)减小,c(OH-)增大
答案为C
本题难度:一般
5、选择题 下列溶液中有关物质的浓度关系正确的是 (?)
A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) >c[(NH4)2SO4]>c(NH4Cl)
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C.1.0 mol/L Na2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
D.某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-)
参考答案:C
本题解析:A(NH4)2SO4="2" NH4++ SO42-;NH4HSO4= NH4++H++ SO42-;NH4Cl= NH4++Cl-。由于每摩尔的(NH4)2SO4产生2摩尔的NH4+离子,而每摩尔的NH4HSO4、NH4Cl只能产生1摩尔的NH4+离子。所以假如忽略NH4+离子的水解作用,当c(NH4+)相等时,(NH4)2SO4的浓度最小。NH4+离子的水解使溶液显酸性,而NH4HSO4电离产生的H+对NH4+离子的水解起到了抑制作用。c(NH4+)相等时,c(NH4Cl)>c(NH4HSO4)。故A.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中: c(NH4Cl)>c(NH4HSO4) >c[(NH4)2SO4]。错误。B.向醋酸钠溶液中加入适量醋酸,CH3COONa=CH3COO-+Na+。由于得到的是酸性溶液则CH3COOH的电离作用大于CH3COO-的水解作用。盐的电离作用大于弱电解质的电离。所以离子浓度的大小关系是:c(CH3COO-) >c(Na+)>c(H+)>c(OH-)。错误 。C对于Na2CO3溶液来说,溶液由于水解显碱性。根据质子守恒可得c(OH-)=c(H+)(始)=c(HCO3-)+c(H+)+2c(H2CO3)。正确。D.根据电荷守恒可得在某二元弱酸酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+2c(A2-).错误。
本题难度:一般