微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)CO、CH4均为常见的可燃性气体。已知在101kPa时,CO的燃烧热为283kJ/mol。相同条件下,若2molCH4完全燃烧生成液态水,所放出的热量为1molCO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是 。
(2)已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ?mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ?mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ?mol—1,PCl3中P-Cl键的键能为1.2c kJ?mol—1。则Cl-Cl键的键能为 kJ?mol—1
(3)已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H
为 (用△H1、△H2、△H3表示)
(4)已知一定温度和压强下,合成氨反应:
N2(g)+3H2(g) 2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量。
2NH3(g)△H=-92.0KJ·mol-1,将1mol N2和3mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时在该容器中充入2mol NH3,反应达到平衡时的热量变化是 (填“吸收”或“放出”) kJ热量。
2、选择题 盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=-24.8kJ·mol-1
②3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=-47.4kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式: 。
3、填空题 已知1molH2完全燃烧生成气态水时放出热量241.8kJ,又知当1g气态水变为液态水时,放出的热量为2.44kJ,请完成液态水分解的热化学方程式______________________________
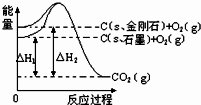
4、选择题 如图所示,△H1=-393.5kJ?mol-1△H2=-395.4kJ?mol-1,下列说法或表示式正确的是( )
A.C(s、石墨)=C(s、金刚石)△H=+1.9kJ?mol-1
B.石墨的能量比金刚石高
C.金刚石的稳定性强于石墨
D.金刚石燃烧的热化学方程式为:C(s、金刚石)+O2(g)=CO2(g)△H=395.4kJ?mol-1