微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 乙酸是生活中常见的一种有机物,下列关于乙酸的说法中正确的是( )。
A.乙酸的官能团为—OH
B.乙酸的酸性比碳酸弱
C.乙酸能够与金属钠反应产生氢气
D.乙酸能使紫色的石蕊试液变蓝
参考答案:C
本题解析:乙酸的官能团为—COOH;乙酸的酸性比碳酸强;乙酸溶液显酸性,能使紫色的石蕊试液变红。
本题难度:简单
2、选择题 下列变化,能证明硫酸是强酸的事实是
[? ]
A.能使石蕊试液变红?
B.能跟磷酸钙反应制磷酸
C.能跟氯化钠反应制氯化氢?
D.能跟锌反应产生氢气
参考答案:B
本题解析:
本题难度:简单
3、填空题 合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为N2 (g) +3H2(g)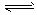 2NH3(g)
2NH3(g)
△H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)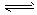 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。
①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
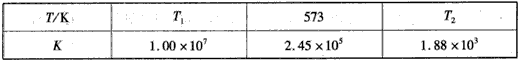
(3)673 K、30 MP a下,n(NH3)和n(H2)随时间变化的关系如下图所示,下列有关叙述正确的是___(填序号)。

A.c点表示n( NH3)和n(H2)相等
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。
参考答案:(1)①1; ②50%
(2)<
(3) ACD
(4)充入空气,NO转化为NO2,NO2继续与水反应生成HNO3,有利于提高原料利用率
(5) CH4(g)+2NO2(g)==CO2(g)+2H2O(g)+N2(g) △H= -867 kJ·mol-1
本题解析:
本题难度:一般
4、填空题
(1)3.320 g该羧酸中碳原子的物质的量为______;
(2)列式计算3.320 g该羧酸中氢、氧原子的物质的量H______mol、O______mol;
(3)该羧酸中C、H、O的原子数之比为______;
(4)写出符合以上各条件的相对分子质量最小的芳香族羧酸的结构简式。
参考答案:(1)0.1600 mol (2)0.1200 mol? 0.08000 mol? (3)4∶3∶2
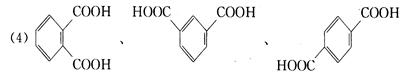
本题解析:将该芳酸构造为:(H2O)x(CO2)yCz,则:
(H2O)x(CO2)yCz(l)+zO2(g) xH2O(l)+yCO2(g)+zCO2(g)
xH2O(l)+yCO2(g)+zCO2(g)
由于:2Na2O2+2CO2====2Na2CO3+O2,
所以,V(CO2)="1.792" L×2="3.584" L,n(C)=n(CO2)="0.1600" mol,m(CO2)="7.040" g
V(O2)="3.584" L-0.224 L="3.360" L,m(O2)="4.800" g
由于:m(芳酸)+m(O2)=m(CO2)+m(H2O),所以,m(H2O)="1.080" g
n(H)=2n(H2O)="0.1200" mol
m(酸中O)=m(芳酸)-m(C)-m(H)="1.280" g,
n(酸中O)="0.08000" mol
余易求。
本题难度:一般
5、填空题 硫酸和硝酸是中学阶段常见的强酸.根据二者与金属的反应情况,回答下列问题:
(1)①在100mL?18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是______.A.33.6L?B.22.4L?C.20.16L?D.6.72L
②若向上述反应①的体系中再加入硝酸钠,有什么现象出现?用必要的文字和离子方程式加以说明______.
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集气体1.12L(标准状况),则该气体的成分是______,反应中所消耗的硝酸的物质的量可能为下列数据中的______.A.0.1mol?B.0.15mol?C.0.2mol?D.0.25mol.
参考答案:(1)①100mL?18mol?L-1的浓硫酸中含硫酸的物质的量为:0.1L×18mol?L-1═1.8mol?
铜与浓硫酸反应的方程式为:
Cu+2H2SO4?△?.?CuSO4+SO2↑+2H2O,
? 2mol?22.4L
? 1.8mol?V
V=1.8mol×22.4L2mol═20.16L,由于铜与稀硫酸不反应,故实际上产生的气体体积小于20.16L,
故选:D.
②原溶液中有稀硫酸,加入硝酸钠,相当于存在硝酸,故铜继续溶解,铜把硝酸根还原为一氧化氮,一氧化氮不稳定,迅速和氧气生成二氧化氮.故答案为:铜片继续溶解,有无色气体生成(无色气体后变为红棕色),有关离子方程式为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)铜与浓硝酸反应产生二氧化氮,随反应进行,硝酸变稀,与稀硝酸反应产生一氧化氮,故收集气体为二者的混合物.故答案为:NO2、NO;
所消耗硝酸分为两部分,被还原硝酸和没被还原硝酸.被还原硝酸可根据N守恒得:n(HNO3)═n(NO2+NO)═1.12L÷22.4L/mol═0.05mol,没被还原的硝酸可根据电荷守恒求得范围,
若只产生二氧化氮,则铜失电子数为:0.05mol×(5-4)═0.05mol(铜失电子数等于硝酸得电子数),没被还原的硝酸为0.05mol;
若只产生一氧化氮,则铜失电子数为:0.05mol×(5-2)═0.15mol(铜失电子数等于硝酸得电子数),没被还原的硝酸为0.15mol,
因此没被还原的硝酸介于0.05~0.15mol之间,故参加反应的硝酸介于0.10~0.20mol之间,
故选:B.
本题解析:
本题难度:一般