微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应反应过程中H2、N2和NH3物质的量变化如下图所示,下列说法正确的是
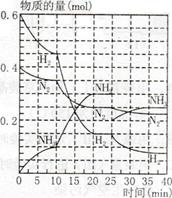
A.反应开始到第一次平衡时,N2的平均反应速率为0.005 mol/(L·min)
B.从曲线可以看出,反应进行到10min至20min时可能是使用了催化剂
C.从曲线可以看出,反应进行至25min时,增加了0.1mol氨气
D.在25min平衡正向移动但达到新平衡后NH3的体积分数比原平衡小
参考答案:D
本题解析:A、到达第一次平衡的时间是10min,此时N2的物质的量减少0.05mol,所以N2的平均反应速率为0.05mol/2L/10min="0.0025" mol/(L·min),错误;B、反应进行到10min至20min时,平衡移动了说明不是加了催化剂,因为催化剂对平衡的移动无影响,错误;C、从曲线可以看出,反应进行至25min时,氮气、氢气的物质的量没变化,而氨气的物质的量降为0.2mol,减少了0.1mol,错误;D、25min时氨气减少0.1mol,所以平衡正向移动,通过计算可知氨气的体积分数还是比原平衡减小了(或勒夏特列原理),正确,答案选D。
本题难度:一般
2、选择题 对于反应N2+O2?

2NO在密闭容器中进行,下列哪些条件能加快反应的速率( )
A.缩小体积使压强增大
B.体积不变充入N2使压强增大
C.体积不变充入H2使压强增大
D.压强不变充入稀有气体氖
参考答案:A.缩小体积,反应物的浓度增大,反应速率增大,故A正确;
B.体积不变充入N2使压强增大,反应物的浓度增大,反应速率增大,故B正确;
C.体积不变充入H2使压强增大(不考虑氢气与氧气的反应),但参加反应的物质的浓度不变,反应速率不变,
D.压强不变充入稀有气体氖,体积增大,反应物的浓度减小,则反应速率减小,故D错误.
故选AB.
本题解析:
本题难度:一般
3、简答题 经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验.回答相关问题:
(1)如图甲可通过观察______,比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______.写出H2O2在二氧化锰作用下发生反应的化学方程式:______.
(2)有同学认为H2O2常温下也可能分解.为了使定性实验的结果更具说服力,你提出的建议是______.
(3)如图乙所示,实验时均以生成?40mL?气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是______.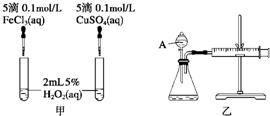
参考答案:(1)该反应中产生气体,所以可根据生成气泡的快慢判断,氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用;硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,双氧水在二氧化锰作用下生成水和氧气,所以反应方程式为2H2O2?MnO2?.?2H2O+O2↑,
故答案为:反应产生气泡的快慢;控制阴离子相同,排除阴离子的干扰;2H2O2?MnO2?.?2H2O+O2↑;
(2)为了使定性实验的结果更具说服力,可以做一个对照试验:加催化剂和不加催化剂条件下时,双氧水的分解情况对比,具体操作是:取一试管,加入2mL5%?H2O2溶液,不加入任何试剂,作空白对照,故答案为:取一试管,加入2mL5%H2O2溶液,不加入任何试剂,作空白对照;
(3)该反应是通过生成气体的反应速率分析判断的,所以根据v=△V△t判知,需要测量的数据是产生40ml气体所需要的时间,故答案为:收集40mL气体所需要的时间.
本题解析:
本题难度:一般
4、选择题 反应4NH3(气)+5O2(气)?

4NO(气)+6H2O(气)在2升的密闭容器中进行,1分钟后,NH3减少了0.12摩尔,则平均每秒钟浓度变化正确的是( )
A.NO:0.001摩/升
B.H2O:0.002摩/升
C.NH3:0.002摩/升
D.O2:0.00125摩/升
参考答案:由1分钟后,NH3减少了0.12摩尔,则用NH3表示的化学反应速率为V(NH3)=△C△t=△n?V?△t?=0.12mol?2L60s=0.001mol?(L?s)-1
A、由化学反应速率之比等于化学计量数之比,则v(NO)=V(NH3)=0.001 mol?(L?s)-1,所以NO平均每秒钟浓度变化为0.001摩/升,故A正确;
B、由化学反应速率之比等于化学计量数之比,则V(H2O)=64V(NH3)=0.0015 mol?(L?s)-1,所以NO平均每秒钟浓度变化为0.0015摩/升,故B错误;
C、因V(NH3)=0.001mol?(L?s)-1,所以NH3平均每秒钟浓度变化为0.001摩/升,故C错误;
D、由化学反应速率之比等于化学计量数之比,则V(O2)=54V(NH3)═0.00125 mol?(L?s)-1,所以O2平均每秒钟浓度变化为0.00125摩/升,故D正确;
故选:AD.
本题解析:
本题难度:一般
5、选择题 选取两个完全相同的密闭容器A、B,向A、B中都加入SO2和O2各l g,发生反应2SO2(g) + O2(g)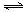 2SO3(g) ;△H<0。反应过程中A保持恒温、恒容,B保持恒温、恒压,并都达到平衡状态。下列说法中,正确的是
2SO3(g) ;△H<0。反应过程中A保持恒温、恒容,B保持恒温、恒压,并都达到平衡状态。下列说法中,正确的是
A.平衡时SO2的转化率:A > B
B.可逆反应从开始到平衡放出的热量:A < B
C.平衡时混合气体的总物质的量:A < B
D.平衡时的化学反应速率:A > B
参考答案:B
本题解析:略
本题难度:简单