微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 用NA表示阿伏加德罗常数,下列说法正确的是:
A.用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA
B.13gNO2和33gN2O4混合气体中含N原子数为NA
C.28gCO和22.4LN2含有的分子数均为NA
D.等物质的量的NH4+和OH-含电子数均为10NA
参考答案:B
本题解析:A、Fe(OH)3胶体中胶粒是大量Fe(OH)3分子的集合体,用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数小于0.1NA,错误;B、NO2和N2O4的最简式均为NO2,46gNO2和N2O4混合气体中含最简式的物质的量为1mol,N原子数为NA,正确;C、缺少条件标准状况,无法确定22.4LN2含有的分子数,错误;D、NH4+和OH-物质的量不确定,所含电子数不确定,错误。
本题难度:一般
2、计算题 现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液。现做如下实验,请回答:

(1)甲瓶溶液为____溶液,其物质的量浓度为__________mol/L。
(2)乙瓶溶液为____溶液,其物质的量浓度为__________mol/L。
参考答案:(1)AlCl3;0.5
(2)NaOH;0.5
本题解析:
本题难度:一般
3、选择题 下列溶液中的c?(Cl-)与100mL1mol?L-1?氯化铝溶液中的c?(Cl-)相等的是( )
A.300mL1mol?L-1氯化钠溶液
B.150mL2mol?L-1氯化铵溶液
C.75mL3mol?L-1氯化钾溶液
D.125mL1.5mol?L-1氯化钡溶液
参考答案:A、300mL1mol?L-1氯化钠溶液中氯离子的物质的量浓度=1mol/L×1=1mol/L;
B、150mL2mol?L-1氯化铵溶液中氯离子的物质的量浓度=2mol/L×1=2mol/L;
C、75mL3mol?L-1氯化钾溶液中氯离子的物质的量浓度=3mol/L×1=3mol/L;
D、125mL1.5mol?L-1氯化钡溶液中氯离子的物质的量浓度=1.5mol/L×2=3mol/L;
故选CD.
本题解析:
本题难度:一般
4、选择题 一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示.下列有关叙述正确的是(? )
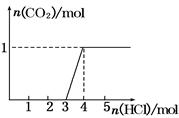
A.通入的CO2气体为22.4 L
B.A溶液中既含Na2CO3,又含NaHCO3
C.A溶液中n(NaOH)=2n(Na2CO3)
D.A溶液中一定只有Na2CO3
参考答案:C
本题解析:根据碳酸钠与盐酸的反应情况:①Na2CO3+HCl=NaHCO3+NaCl;②NaHCO3+HCl=NaCl+CO2↑+H2O。开始滴入3 mol HCl无气体生成,后滴入1 mol盐酸,生成1 mol CO2,而后再滴加盐酸无气体生成,说明A溶液为氢氧化钠与碳酸钠的混合物,根 91ExAM.org据上述化学反应机理,可以推断A溶液中碳酸钠为1 mol,氢氧化钠为2 mol,故B项D项错误,C项正确,A项没有标明为标准状况,错误。
本题难度:一般
5、填空题 今欲用NaOH固体配制100mL0.5mol/L的NaOH溶液.配制过程如图所示:
请根据题意回答:
(1)配制该溶液应选用______(填仪器).
(2)用小烧杯在托盘天平上称取______NaOH固体.
(3)向容量瓶中加入蒸馏水,如果超过了刻度线,应______.
(4)配制好的溶液______(填“能”或“不能”)长期存放在容量瓶中.
(5)以下因素会造成实验结果偏低的是______(填序号)
a.容量瓶中原来有少量蒸馏水 b.定容时观察液面俯视
c.忘记洗涤d.定容时观察液面仰视.
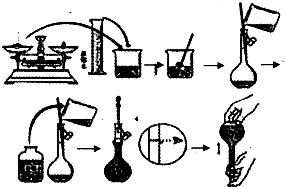
参考答案:(1)容量瓶的规格与溶液的体积一致,NaOH溶液的体积为100mL,所以容量瓶的规格为100mL;
故答案为:100mL容量瓶;
(2)配制100mL0.5mol/L的NaOH溶液需NaOH的质量m(NaOH)=nM=cvM=0.5mol/L×0.1L×40mol/mol=2.0g;
故答案为:2.0g;
(3)配制溶液过程中出现的错误都需重新配制;
故答案为:重新配制;
(4)容量瓶不能存放溶液,所以配制好的溶液不能长期存放在容量瓶中;
故答案为:不能;
(5)a.容量瓶中原来有少量蒸馏水,对溶液的体积、溶质的物质的量均无影响,溶液的浓度不变,故a错误;
b.定容时观察液面俯视,溶液的液面低于刻度线,溶液的体积偏小,溶液的浓度偏大,故b错误;
c.忘记洗涤,因烧杯和玻璃棒上占有溶质,溶质的质量偏少,溶液的浓度偏低,故c正确;
d.定容时观察液面仰视,溶液的液面高于刻度线,溶液的体积偏大,溶液的浓度偏低,故d正确;
故答案为:cd;
本题解析:
本题难度:一般