| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《离子方程式的书写及正误判断》答题技巧(2017年最新版)(六)
参考答案:C 本题解析:次溴酸是弱酸,写化学式,A项错误;少量H2SO4滴入Ba(OH)2溶液中,不符合阴阳离子的比例关系,应为:Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓+ 2H2O,B项错误;NaHSO4属于强电解质,电离出H+,离子方程式为HCO3- + H+ = H2O + CO2↑,C项正确;碳酸钙在过量CO2中生成碳酸氢钙,D项错误;选C。 本题难度:一般 2、选择题 下列反应的离子方程式错误的是 |
参考答案:C
本题解析:A、向碳酸氢钙溶液中加入过量氢氧化钠,碳酸氢根离子无剩余,生成碳酸钙沉淀、碳酸根离子、水,正确;B、氢氧化钡溶液与硫酸氢钠溶液1:1混合时,1个氢离子与1个氢氧根离子反应,硫酸根离子与钡离子结合生成硫酸钡沉淀,正确;C、氢氧化钙溶液和碳酸氢镁反应除生成碳酸钙沉淀外还有氢氧化镁的沉淀生成,错误;D、向溴化亚铁溶液中通入过量氯气,则溴离子、亚铁离子全部被氧化,正确,答案选C。
考点:考查离子方程式的书写的判断
本题难度:一般
3、填空题 现有稀盐酸、稀硫酸、氢氧化钡、碳酸钠四瓶失去标签的溶液,分别编号为A、B、C、D每次取少量溶液两两混合,所观察到的现象如表,“一”表示无明显现象;“↓”表示有沉淀生成;“↑”表示有气体生成。
(1)则A ,B ,
C ,D ;(写化学式)
(2 )写出实验过程中有关物质间反应的离子方程式
)写出实验过程中有关物质间反应的离子方程式
B +C
参考答案:(1)则A:H2SO4,B:Na2CO3 C:Ba(OH)2 D:HCl
(2)Ba2++ CO32-===BaCO3↓
CO32-===BaCO3↓
本题解析:略
本题难度:一般
4、填空题 现有含淀粉、NaCl、Na2SO4、CaCl2的混合溶液,选择适当的试剂和方法从中提纯出NaCl晶体。相应的实验过程如下: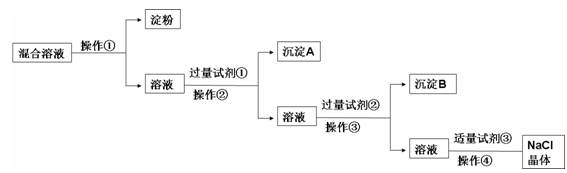
(1)a.操作①是利用胶体中胶体粒子______________(填“能”或“不能”)透过半透膜,溶液溶质分子、离子__________(填“能”或“不能”)透过半透膜进行分离提纯。
b.如何用实验证明淀粉未透过半透膜而Cl-已透过半透膜:
______________________________________________________
_____________ ______
(2)写出上述实验过程中所用试剂:
试剂①_______________________;试剂③________________________。
(3)判断试剂①已过量的方法是:________________________________________。
(4)用化学方程式表示加入试剂②的作用:
________________________________________________________ ____________
(5)操作④的名称是__________________________。
参考答案:(1)a.不能; 能;
b.用两支试管分别取半透膜外的溶液,往其中一支试管滴加AgNO3溶液,产生白色沉淀,说明Cl-已透过半透膜;往另一支试管滴加碘水,溶液不变蓝,说明淀粉未透过半透膜。
(2)氯化钡溶液;稀盐酸
(3)静置,向上层清液中滴加少量氯化钡溶液,没有白色沉淀产生,说明氯化钡溶液已过量。
(4)BaCl2+Na2CO3=2NaCl+BaCO3↓ CaCl2+Na2CO3=2NaCl+CaCO3↓
(5)蒸发(结晶)
本题解析:略
本题难度:一般
5、选择题 (6分)写出下列反应的离子方程式:
(1)稀盐酸除铁锈
(2)澄清石灰水中通入少量的CO2
(3)H2SO4和Ba(OH)2的反应
参考答案:28.(6分)(1)Fe2O3+6H+
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《有机合成与.. | |